Содержание
- 2. Цели урока: Закрепить понятия «обратимость» и «необратимость» химических реакций; обобщить и углубить знания учащихся о химическом
- 3. Основные понятия: Обратимые и необратимые химические реакции, химическое равновесие, равновесные концентрации, константа равновесия, скорость реакции, принцип
- 4. Ход урока. Фронтальный опрос 1. Определение скорости химической реакции. 2. Формулы выражения скорости и единицы измерения
- 5. Изучение нового материала. План изложения. 1.Реакции обратимые и необра-тимые. Признаки необратимости 2. Химическое равновесие. Константа химического
- 6. Обратимые и необратимые реакции. Обратимые химические реакции – это реакции, одновременно протека – ющие в прямом
- 7. Признаки необратимости. CuCl2 + 2KOH=Cu(OH)2↓ +2KOH – выпал осадок Na2CO3 + 2HCl=2NaCl + H2O + CO2↑
- 8. Химическое равновесие. Вернемся к обратимой реакции водорода с парами йода. В соответствии с законом действующих масс
- 9. Константа химического равновесия. Состояние химического равновесия характеризуется особой величиной – константой равновесия. Для нашего примера константа
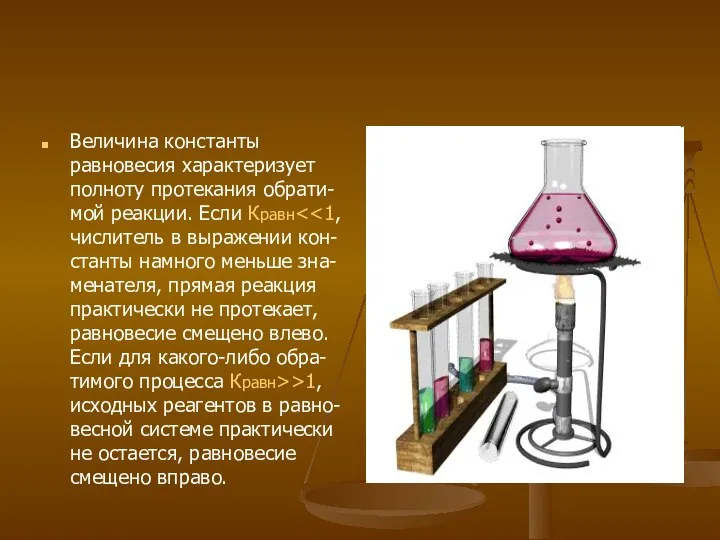
- 10. Величина константы равновесия характеризует полноту протекания обрати- мой реакции. Если Кравн >1, исходных реагентов в равно-
- 11. Факторы, вызывающие смещение химического равновесия. Состояние химического равновесия может сохранять-ся долго при неизменных внешних условиях: температуры,
- 12. Историческая справка. Анри Луи Ле Шателье (1850- 1936), французский ученый- химик, занимался исследова-ниями процессов протекания химических
- 13. Принцип Ле Шателье. Известен всюду на Земле Анри Луи Де Шателье. Он не был королем и
- 14. Изменение концентрации: А) если увеличиваем концентрацию конечных продуктов, рав- новесие смещается в сторону образования исходных продуктов,
- 15. Влияние изменения давления. А) при увеличения давления равновесие смещается в сторону той реакции, при которой объем
- 16. Влияние изменения температуры. А) при повышении температуры химическое равновесие смещается в сторону эндотермической реакции. Б) при
- 17. Значение принципа Ле Шателье.
- 18. Производство аммиака и метанола.
- 19. Закрепление. Химик толкает реакцию в спину: «Давай-ка тебя я немного подвину!» Она отвечает: «Ты знаешь меня:
- 20. Задания ЕГЭ . 1. Условие необратимости химического превращения. а) образование слабого электролита б) поглощение большого количества
- 21. 4. Верны ли следующие суждения о смещении химического равновесия в системе 2CO(г) + O2(г) ↔ 2CO2(г)
- 22. Проверь себя! 1 – а 2 – б 3 – в 4 – а 5 –
- 24. Скачать презентацию




















 Химическая связь
Химическая связь Разработка методики расчета фазового равновесия при длительном хранении СПГ
Разработка методики расчета фазового равновесия при длительном хранении СПГ Изомерия алкенов
Изомерия алкенов Галогены и их соединения
Галогены и их соединения Самородные минералы
Самородные минералы Периодический закон, 9 класс (1)
Периодический закон, 9 класс (1) Азотсодержащие органические соединения
Азотсодержащие органические соединения Цинк и его применение (11 класс)
Цинк и его применение (11 класс) Магматические горные породы
Магматические горные породы Химические реакции
Химические реакции Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Электронная структура атомов
Электронная структура атомов Оксиды
Оксиды Классификация органических веществ
Классификация органических веществ Рений. Содержание рения в земной коре
Рений. Содержание рения в земной коре Нефть и способы её переработки
Нефть и способы её переработки Металлы. Химия. 11 класс
Металлы. Химия. 11 класс Сухая вода помогла измерить поляризацию ковалентных связей
Сухая вода помогла измерить поляризацию ковалентных связей Валентность
Валентность Химический состав клетки
Химический состав клетки Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат
Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат Типы химических реакций. Классификация химических реакций по числу и составу реагентов и продуктов ХР
Типы химических реакций. Классификация химических реакций по числу и составу реагентов и продуктов ХР Образование и получение веществ
Образование и получение веществ Разминка
Разминка Алкины (ацетиленовые углеводороды)
Алкины (ацетиленовые углеводороды) Презентация на тему Природные источники углеводородов (9 класс)
Презентация на тему Природные источники углеводородов (9 класс)  Особенности строения алкенов
Особенности строения алкенов