Содержание
- 2. ОГЛАВЛЕНИЕ Скорость химической реакции. Скорость химической реакции. Энергия активации. Факторы, влияющие на скорость химической реакции: природа
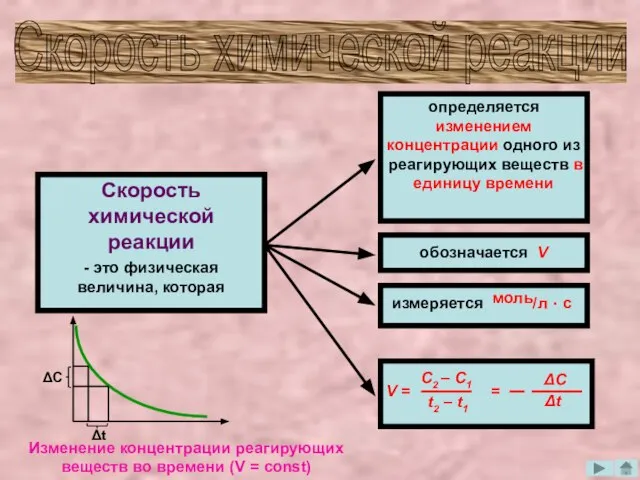
- 3. Скорость химической реакции Скорость химической реакции - это физическая величина, которая определяется изменением концентрации одного из
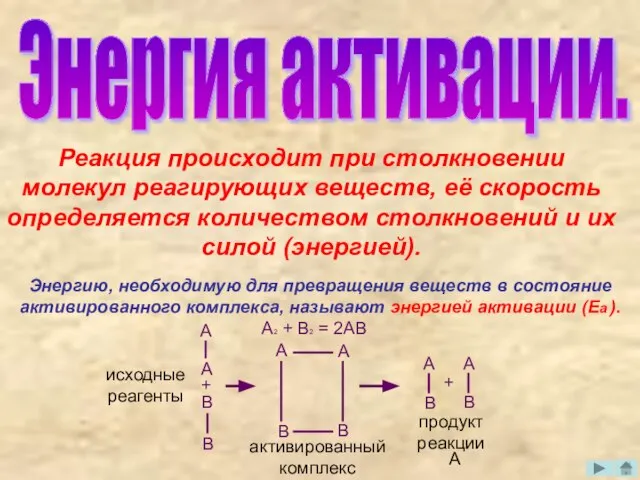
- 4. Энергия активации. Реакция происходит при столкновении молекул реагирующих веществ, её скорость определяется количеством столкновений и их
- 5. 2 Na + 2H2O = 2NaOH + H2 (всегда) Zn + H2O = ZnO + H2
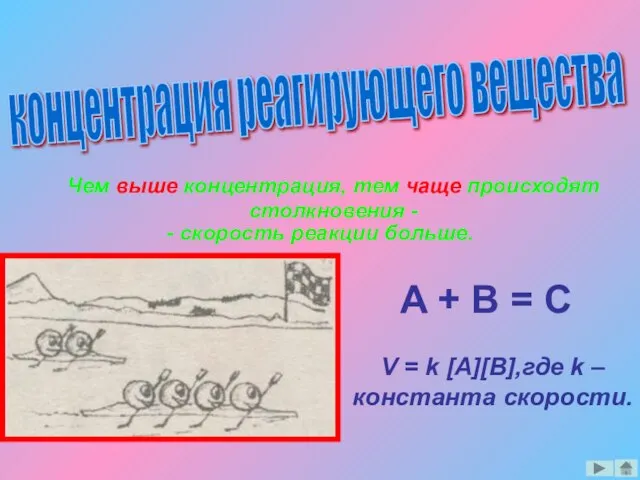
- 6. концентрация реагирующего вещества Чем выше концентрация, тем чаще происходят столкновения - - скорость реакции больше. A
- 7. Температура При повышении температуры на каждые 10 градусов скорость реакции возрастает в 2-4 раза (правило Вант-Гоффа).
- 8. Поверхность соприкосновения реагирующих веществ Для гетерогенных систем * скорость прямо пропорциональна поверхности соприкосновения реагирующих веществ. Твёрдое
- 10. Скачать презентацию




 Строение вещества. Виды химической связи
Строение вещества. Виды химической связи Решение задач на основные законы и понятия химии
Решение задач на основные законы и понятия химии Спирты и их производные
Спирты и их производные Строение, свойства, биологическая роль дезоксисахаров и аминосахаров
Строение, свойства, биологическая роль дезоксисахаров и аминосахаров Гетерогенные химические системы и поверхностные явления в них
Гетерогенные химические системы и поверхностные явления в них Метанол. Краткая характеристика
Метанол. Краткая характеристика Использование катионных красителей в экстракционно-флуориметрическом анализе
Использование катионных красителей в экстракционно-флуориметрическом анализе Основания. Простые и сложные ионы
Основания. Простые и сложные ионы Строение и химические свойства галогенов
Строение и химические свойства галогенов Методы пробоотбора и пробоподготовки донных отложений, почв и грунтов
Методы пробоотбора и пробоподготовки донных отложений, почв и грунтов Основные понятия и законы химии
Основные понятия и законы химии Разбор задач
Разбор задач Классы веществ
Классы веществ Предельные углеводороды. Урок №4
Предельные углеводороды. Урок №4 Презентация на тему Природный и попутный газ
Презентация на тему Природный и попутный газ  Лекарственные средства – производные пиримидин 2,4,6-триона
Лекарственные средства – производные пиримидин 2,4,6-триона Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса
Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса Очистка поверхности медного сплава
Очистка поверхности медного сплава Роль М.В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения
Роль М.В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения Сульфиды
Сульфиды Alkini
Alkini Критерии оценки качества природного газа
Критерии оценки качества природного газа Современные способы защиты ОТТ
Современные способы защиты ОТТ Определение химического эквивалента, эквивалентной и атомной массы металла
Определение химического эквивалента, эквивалентной и атомной массы металла Простые и сложные вещества. Основные классы неорганических веществ
Простые и сложные вещества. Основные классы неорганических веществ Азотная кислота и ее соли. Специфические свойства азотной кислоты
Азотная кислота и ее соли. Специфические свойства азотной кислоты Интеллектуальная игра по химии Металлы
Интеллектуальная игра по химии Металлы Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии
Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии