Содержание
- 2. Физические свойства золота ЗОЛОТО Чистое золото — мягкий металл жёлтого цвета. Золото — очень тяжёлый металл:
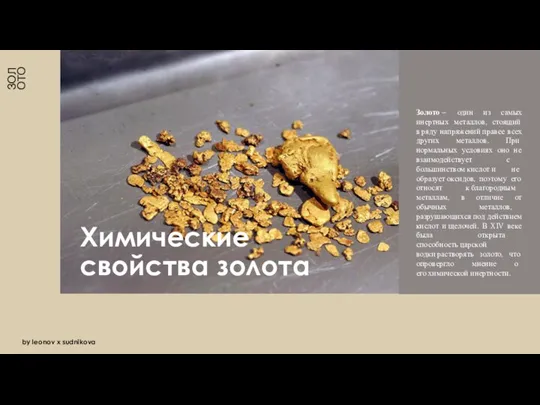
- 3. ЗОЛОТО Химические свойства золота by leonov x sudnikova Золото — один из самых инертных металлов, стоящий
- 4. Система проб 375 проба Основные компоненты — серебро и медь, золота — 38 %. Оно тускнеет
- 6. Скачать презентацию
Слайд 2Физические свойства золота
ЗОЛОТО
Чистое золото — мягкий металл жёлтого цвета.
Золото — очень тяжёлый металл: плотность чистого золота равна
Физические свойства золота
ЗОЛОТО
Чистое золото — мягкий металл жёлтого цвета.
Золото — очень тяжёлый металл: плотность чистого золота равна

оно может быть проковано в листки толщиной до 100 нм, такое золото называют сусальным. Температура плавления золота 1064,18 °, кипит при 2856 °C. Жидкое золото довольно летучее, оно активно испаряется задолго до температуры кипения.
Слайд 3ЗОЛОТО
Химические свойства золота
by leonov x sudnikova
Золото — один из самых инертных металлов, стоящий
ЗОЛОТО
Химические свойства золота
by leonov x sudnikova
Золото — один из самых инертных металлов, стоящий
Слайд 4Система проб
375 проба
Основные компоненты — серебро и медь, золота — 38
Система проб
375 проба
Основные компоненты — серебро и медь, золота — 38

585
проба
Основные компоненты — серебро, медь, палладий, никель, золота — 58,5 %. Проба достаточно высока, этим обусловлены многочисленные положительные качества сплава: твёрдость, прочность, устойчивость на воздухе. Широко применяется при изготовлении ювелирных украшений.
750 проба
Основные компоненты — серебро, платина, медь, палладий, никель, золота — 75,0 %.
Положительные свойства: подверженность полировке, твёрдость, прочность, хорошо обрабатывается. Цветовая гамма — от зелёного через ярко-жёлтый до розового и красного. Используется в ювелирном искусстве, особенно для филигранных работ.
ЗОЛОТО
 Реакции в органической химии
Реакции в органической химии Презентация на тему Кристаллические решетки 9 класс
Презентация на тему Кристаллические решетки 9 класс  Явления, смеси и способы их разделения
Явления, смеси и способы их разделения Лекция_классы_неогранических_соединений
Лекция_классы_неогранических_соединений Металлы
Металлы Физические и химические явления
Физические и химические явления Методы выделения и разделения радионуклидов
Методы выделения и разделения радионуклидов Арены. Бензол
Арены. Бензол Основные классы неорганических веществ
Основные классы неорганических веществ Презентация на тему Щелочноземельные металлы
Презентация на тему Щелочноземельные металлы  Теоретические основы органической химии. Лекция 25
Теоретические основы органической химии. Лекция 25 Степень окисления
Степень окисления Получение металлов в промышленности. Чёрная металлургия
Получение металлов в промышленности. Чёрная металлургия Силикатная промышленность и её продукция
Силикатная промышленность и её продукция Химическая технология органических веществ
Химическая технология органических веществ Дорогие и дешёвые лекарства: Чем похожи и чем отличаются друг от друга?
Дорогие и дешёвые лекарства: Чем похожи и чем отличаются друг от друга? валентность (1)
валентность (1) Электролиз и его применение
Электролиз и его применение Лавка возможностей
Лавка возможностей Презентация на тему Твердые вещества
Презентация на тему Твердые вещества  Стекло. Технология изготовления стекла
Стекло. Технология изготовления стекла Физико-химическая механика и реология дисперсных структур. Лекция 15
Физико-химическая механика и реология дисперсных структур. Лекция 15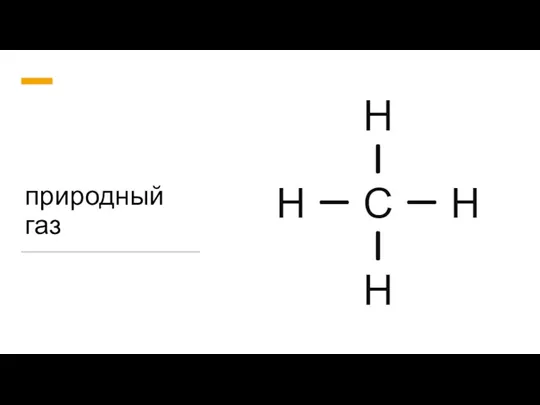 Природный газ
Природный газ Урок по химии в 10 классе на тему: «Жиры» 2008 год.
Урок по химии в 10 классе на тему: «Жиры» 2008 год. Вещество. Простые и сложные вещества
Вещество. Простые и сложные вещества Коррозия металла
Коррозия металла Алкены. Решение задач и упражнений
Алкены. Решение задач и упражнений Анализ свойств карбамидоформальдегидных смол
Анализ свойств карбамидоформальдегидных смол