Слайд 2Химиопрепараты биологического (преимущественно микробного), полусинтетического или синтетического происхождения, которые в малых концентрациях

подавляют развитие или вызывают гибель чувствительных к ним микроорганизмов и опухолевых клеток во внутренней среде животного организма.
Высокая специфичность антибиотиков и их отличие от антисептиков определяются мишенями действия. Мишени действия антибиотиков являются уникальными для прокариот и отсутствуют у эукариот. Благодаря этому препараты этой группы отличаются значительной терапевтической широтой - разницей между концентрациями, оказывающими антибактериальное действие, и концентрациями, проявляющими токсические эффекты на организм человека.
Слайд 3По антимикробному спектру действия:
– узкого - на 1–2 вида бактерий;
– широкого

- на несколько видов бактерий.
Слайд 42. По происхождению:
– микробного происхождения:
из бактерий - грамицидин, полимиксин;
из

грибов - пенициллин;
из актиномицетов - стрептомицин;
– растительного происхождения:
из высших растений - фитонциды, из семян редиса - рафанин, из чеснока - аллизин;
– животного происхождения - эритрин, эмолин;
– полусинтетические и синтетические.
Слайд 53. По типу действия:
– бактериостатические (левомицетин, тетрациклины, линкозамиды, макролиды). Они ингибируют

синтез белков и предотвращают размножение бактерий, но не вызывают их гибели. Бактериостатические антибиотики неэффективны у иммунокомпроментированных организмов;
– бактерицидные (пенициллины, цефалоспорины, аминогликозиды, рифампицин, полипептиды). Они уничтожают микроорганизмы, нарушая проницаемость ЦПМ или ингибируя синтез РНК. Для характеристики типа действия препарата определяют его минимальную ингибирующую концентрацию (МИК) и минимальную бактерицидную концентрацию (МБК). Препарат является бактерицидным, если МБК равна МИК или превышает ее.
Слайд 64. По направленности действия:
– противобактериальные;
– противопротозойные;
– противоопухолевые.

Слайд 75. По химическому строению:
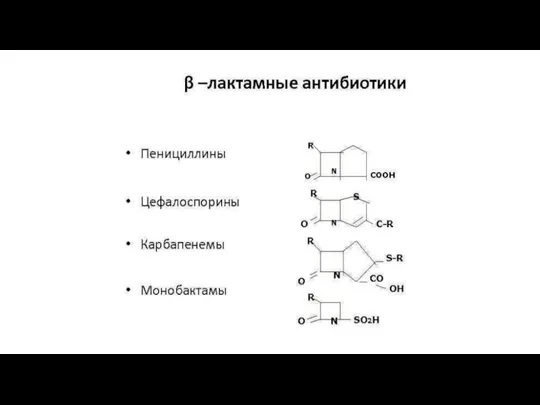
β-Лактамные антибиотики (β-лактамы)
Азотсодержащие гетероциклические соединения с β-лактамным кольцом.

Блокируют синтез пенициллинсвязывающих белков, входящих в состав КС бактерий. Действуют бактерицидно на размножающиеся бактерии. Между отдельными представителями группы β-лактамов существуют значительные различия в уровне и спектре антибиотической активности.
К ним относятся пенициллины, цефалоспорины, карбапенемы, монобактамы.
Слайд 91.1. Пенициллины
Механизм действия: пенициллины обладают преимущественно бактерицидным эффектом. Они препятствуют синтезу пептидогликана,

подавляют транспептидазную реакцию синтеза компонентов клеточной стенки.
Для преодоления широко распространённой среди микроорганизмов приобретённой устойчивости, связанной с продукцией β-лактамаз, разрушающих β-лактамы, были разработаны защищённые пенициллины, включающие соединения, способные необратимо подавлять активность β-лактамаз (ингибиторы β-лактамаз).
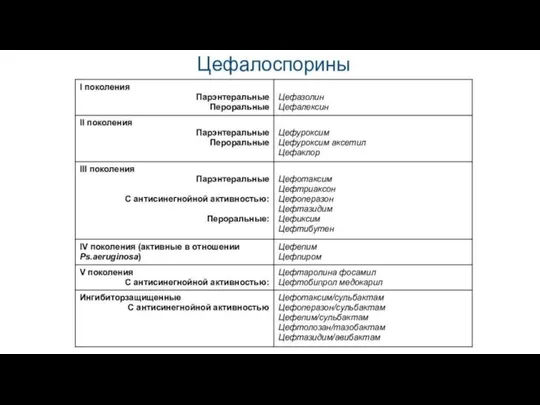
Слайд 12 1.2. Цефалоспорины
Проявляют бактерицидное действие, механизм которого связан с повреждением клеточной стенки бактерий,
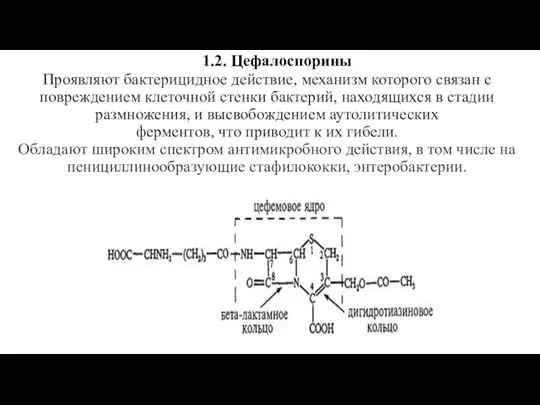
находящихся в стадии размножения, и высвобождением аутолитических
ферментов, что приводит к их гибели.
Обладают широким спектром антимикробного действия, в том числе на пенициллинообразующие стафилококки, энтеробактерии.
Слайд 14
1.3. Карбапенемы (имипенем (тиенам), меропенем) обладают наиболее широким спектром антибактериальной активности из

всех известных антибиотиков, в т. ч. в отношении штаммов, резистентных к пенициллинам, цефалоспоринам и аминогликозидам.
1.4. Монобактамы (азтреонам). Активны только в отношении аэробных Грам– бактерий (по уровню активности соответствует цефалоспоринам III поколения), резистентны к β-лактамазам.
Слайд 152. Аминогликозиды
Механизм действия: подавление синтеза белка путем необратимого связывания с 30S-субъединицей бактериальных
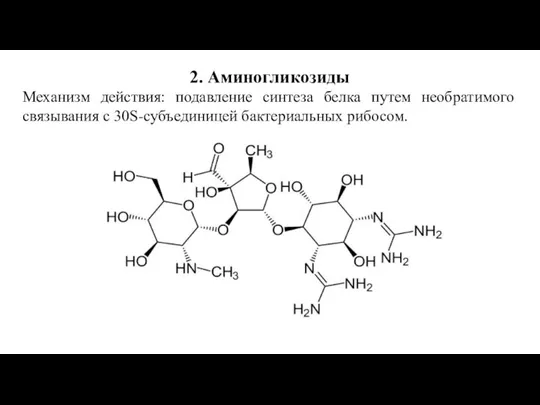
рибосом.
Слайд 17Бактерицидная активность аминогликозидов сильно зависит от pH среды: они значительно менее эффективны

в кислой или нейтральной среде, чем в слабощелочной (при pH около 7,5).
Активность аминогликозидов снижается в присутствии Ca2+ и Mg2+.
Для действия аминогликозидов необходимы аэробные условия. Поэтому данные препараты не действуют на анаэробные микроорганизмы, а также недостаточно эффективны в плохо кровоснабжаемых, гипоксемичных или некротизированных тканях, в полостях абсцессов и кавернах.
Слайд 18Аминогликозиды практически не всасываются из ЖКТ, их вводят внутримышечно или внутривенно. Выводятся

почками, создавая в моче очень высокие концентрации.
Их применяют в сочетании с пенициллинами широкого спектра действия или цефалоспоринами III поколения при тяжелых нозокомиальных инфекциях, острых инфекциях мочевыводящих путей, менингите, кишечном сепсисе, перитоните.
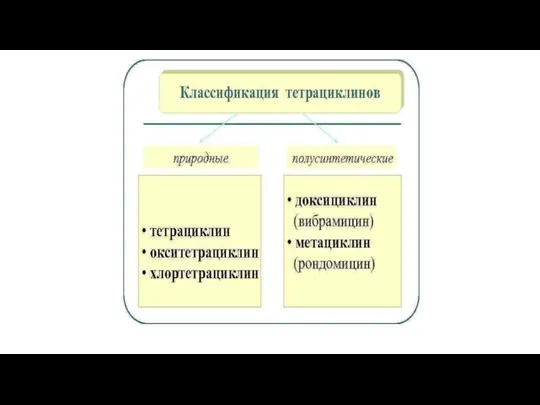
Слайд 193. Тетрациклины
Механизм действия: ингибиция биосинтеза белка путем связывания с 30S-субъединицей бактериальных рибосом.
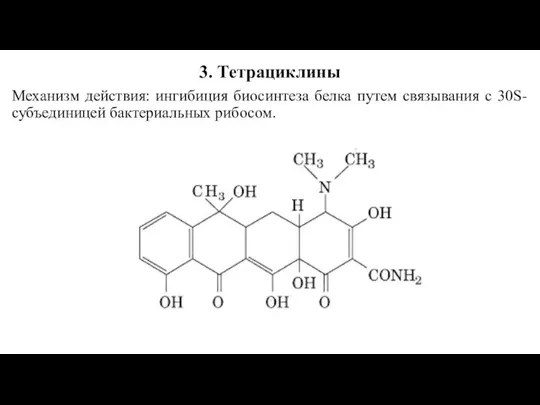
Слайд 21По уровню активности тетрациклины близки между собой, несколько большей активностью отличаются миноциклин

и доксициклин.
Тетрациклины кумулируются в костной ткани, нефротоксичны.
Резистентность к тетрациклинам вырабатывается быстро, при этом наблюдается практически полная перекрестная резистентность. В связи с широким распространением резистентности к тетрациклинам среди микроорганизмов и появлением других высокоактивных антибиотиков клиническое значение препаратов данной группы в последнее время снизилось.
Слайд 224. Левомицетин (хлорамфеникол)
Хлорамфеникол - природный антибиотик, левомицетин - его синтетический аналог.
Механизм
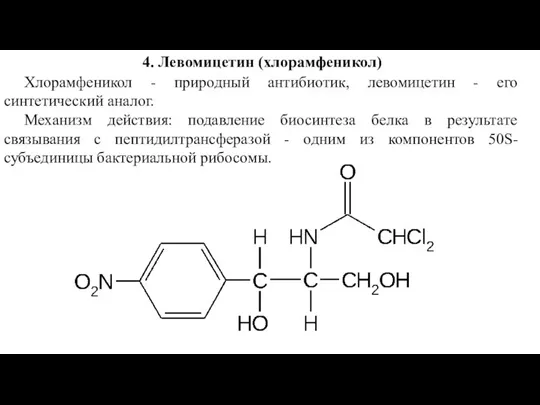
действия: подавление биосинтеза белка в результате связывания с пептидилтрансферазой - одним из компонентов 50S-субъединицы бактериальной рибосомы.
Слайд 23Левомицетин - бактериостатический антибиотик широкого спектра действия, активен в отношении большинства Грам+

и Грам– аэробных и анаэробных микроорганизмов.
Крайне токсичен и часто оставляет тяжёлые побочные эффекты при применении внутрь. В связи с этим практически не применяется и рекомендуется только при отсутствии альтернатив для лечения серьёзных инфекций. Наиболее опасное осложнение применения хлорамфеникола - необратимая апластическая анемия.
Слайд 245. Макролиды и азолиды
Механизм действия: подавление биосинтеза белка в результате связывания антибиотиков
с 50S-субъединицей рибосом. Действуют бактериостатически, на некоторые чувствительные микроорганизмы оказывают бактерицидный эффект.
Слайд 27Наиболее чувствительны к макролидам аэробные Грам+ кокки и палочки, а также некоторые

Грам– аэробы (H. influenzae, M. catarrhalis, Neisseria).
Большое значение имеет активность макролидов в отношении микроаэрофилов - Campylobacter, Helicobacter.
В отношении Escherichia, Salmonella, Shigella только азитромицин проявляет умеренную активность.
Макролиды высокоактивны против факультативных или облигатных внутриклеточных паразитов: Chlamydia, Ureaplasma, Legionella, Mycoplasma, Rickettsia, Treponema, Borrelia.
Макролиды относятся к числу наименее токсичных антибиотиков.
Слайд 286. Полимиксины
Механизм действия основан на влиянии на цитоплазматическую мембрану бактериальной клетки за
счёт взаимодействия с фосфолипидами. Повреждение её структуры приводит к изменению проницаемости для внутри- и внеклеточных компонентов.
Слайд 29Антибактериальная активность полимиксинов распространяется только на грамотрицательную микрофлору.Основное клиническое значение имеет активность

полимиксинов в отношении P. Aeruginosa и Klebsiella (в частности, пневмонии, абсцессы легких, менингиты, сепсис).
При колибактериозах применяют только в случае неэффективности других антибиотиков. Наиболее эффективными антибиотиками из данной группы являются полимиксины E (колистин) и В.
Полимиксин М применяют при вяло текущих местных процессах (инфицированных ожогах, пролежнях, некротических язвах и т. п.) в виде мазей и растворов.
Обладают выраженной нефро- и нейротоксичностью.
Слайд 307. Линкозамиды
Действие обусловлено подавлением в бактериальных клетках синтеза белка. Связывает нуклеотидную субъединицу
23S большой субъединицы бактериальной рибосомы 50S и приводит к преждевременной диссоциации комплекса пептидил-тРНК с рибосомы.
Слайд 31
Используются при инфекциях, вызванных грам+ кокками и неспорообразующей анаэробной флорой. Их обычно сочетают

с антибиотиками, влияющими на грамотрицательную флору (например, аминогликозидами).
К ним относятся линкомицин, клиндамицицин, пирлимицин.
Линкозамиды устойчивы к действию соляной кислоты желудочного сока.
Слайд 328. Гликопептидные антибиотики
Механизм действия: нарушают синтез клеточной стенки бактерий.
Оказывают бактерицидное действие, однако
в отношении энтерококков, некоторых стрептококков действуют бактериостатически.
Слайд 33Гликопептиды активны в отношении грам+ аэробных и анаэробных микроорганизмов: стафилококков, стрептококков, пневмококков,

энтерококков, пептострептококков, листерий, коринебактерий, клостридий.
Грам- микроорганизмы устойчивы к гликопептидам.
Значимые гликопептидные антибиотики: ванкомицин, тейкопланин, телаванцин, блеомицин, рамопланин, декапланин.
Гликопептиды не метаболизируются, выводятся почками в неизмененном виде, поэтому при почечной недостаточности требуется коррекция доз.
Слайд 349. Стероидной структуры: фузидиевая кислота (фузидин)
Механизм действия: подавление синтеза белка путем связывания
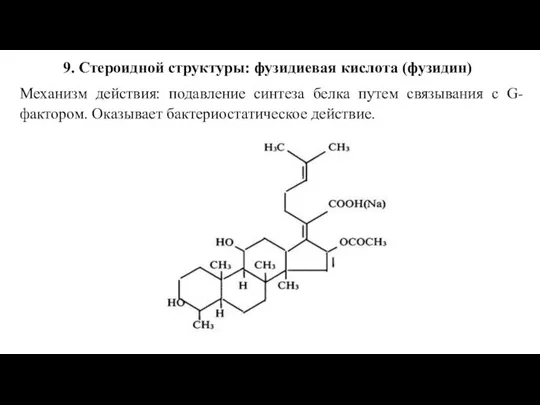
с G-фактором. Оказывает бактериостатическое действие.
Слайд 35Фузидиевая кислота активна только в отношении Грам+ бактерий, наибольшее значение имеет ее

активность в отношении метициллинрезистентных стафилококков.
Ограничения: новорожденные, особенно недоношенные (риск развития билирубиновой энцефалопатии), нарушение функции печени.
Слайд 36Механизмы резистентности микроорганизмов к антибиотикам
Штамм микроорганизмов считается резистентным к антибиотику, если его

рост не подавляется минимальной концентрацией антибиотика, которая обычно подавляет рост бактерий этого вида.
Слайд 37Виды резистентности к антибиотикам
Естественная (природная) резистентность обусловливается одним из следующих механизмов:

– отсутствием у микроорганизма мишени для действия антибиотика (например, пенициллины, подавляющие синтез КС бактерий, не действуют на микоплазм, не имеющих КС);
– недоступностью мишени для действия антибиотика вследствие первично низкой проницаемости КС;
– ферментативной инактивацией антибиотика.
Слайд 382. Приобретенная резистентность - свойство отдельных штаммов бактерий сохранять жизнеспособность при тех

концентрациях антибиотиков, которые подавляют основную часть микробной популяции. Прогнозировать наличие приобретенной резистентности к антибиотикам у конкретного штамма бактерий невозможно.
Приобретенная резистентность по механизму может быть фенотипической и генетической.
Слайд 39Фенотипическая резистентность носит временный характер и возникает под влиянием внешней среды:
1.

Метаболически неактивные микроорганизмы могут быть фенотипически резистентны.
2. Бактерии могут терять специфические рецепторы для антибиотика и становиться резистентными к нему (например, микроорганизмы, чувствительные к пенициллину, могут переходить в L-формы, не имеющие КС, во время курса пенициллинотерапии. При реверсии к родительским бактериальным формам, синтезирующим КС, они вновь становятся чувствительными к пенициллину).
Слайд 40Генетическая резистентность связана с изменением генетического аппарата микробной клетки. Она носит стойкий,

наследственный характер.
Пути возникновения генетической резистентности:
Повышение уровня экспрессии генов, детерминирующих резистентность, в результате спонтанных мутаций в локусе, контролирующем чувствительность к антибиотику. Частота спонтанных мутаций низкая, однако при огромном числе клеток в бактериальной популяции вероятность возникновения изменения, приводящего к превращению чувствительных к антибиотику клеток в резистентные, достаточно велика.
Присутствие антибиотика является селективным фактором, обеспечивающим отбор резистентных мутантов, у которых наблюдается увеличение активности систем выведения антибиотика, утрата или снижение экспрессии пориновых каналов.
Слайд 412. Перенос резистентности между различными видами бактерий с помощью генетических рекомбинаций и

распространение резистентных клонов бактерий.
а) приобретение новой генетической информации - R-плазмид, определяющих множественную резистентность к антибиотикам. R-плазмиды, распространяясь среди бактерий путем конъюгации, формируют своеобразный генофонд лекарственной резистентности микроорганизмов (например, резистентность современных стафилококков к пенициллину доходит до 100 %);
б) передача резистентности от донора к реципиенту при трансформации или трансдукции (например, микроорганизмы, не продуцирующие антибиотики, могут получить гены инактивирующих ферментов от бактерий-продуцентов).





































 МБУЗ Городская больница №6 г. Ростова-на-Дону в цифрах и показателях работы
МБУЗ Городская больница №6 г. Ростова-на-Дону в цифрах и показателях работы Модели медицинского страхования в РФ
Модели медицинского страхования в РФ Обследование стоматологического больного
Обследование стоматологического больного Стресс и адаптация
Стресс и адаптация Гигиенические требования к поликлиникам
Гигиенические требования к поликлиникам Аурикулярия уховидная (Муэр), история применения, лечебно-профилактические свойства
Аурикулярия уховидная (Муэр), история применения, лечебно-профилактические свойства Перфорация желудка и кишечника
Перфорация желудка и кишечника Индивидуальная программа в школе Здоровье
Индивидуальная программа в школе Здоровье Методы обследования беременных и рожениц
Методы обследования беременных и рожениц Предверно-улитковый нерв (n. Vestibulocochlearis)
Предверно-улитковый нерв (n. Vestibulocochlearis) Обработка электрокардиограммы в мониторных системах для контроля аритмий
Обработка электрокардиограммы в мониторных системах для контроля аритмий Метронидазол-Альтфарм
Метронидазол-Альтфарм Алыптасу кезеңіндегі (бозбалалық, бойжеткендік) негізгі проблемалар және оның шешу жолдары
Алыптасу кезеңіндегі (бозбалалық, бойжеткендік) негізгі проблемалар және оның шешу жолдары Патоморфологія захворювань печінки жовчовивідних шляхів
Патоморфологія захворювань печінки жовчовивідних шляхів Аппендицит
Аппендицит История педиатрии
История педиатрии Волевая ликвидация глубокого дыхания. Метод ВЛГД
Волевая ликвидация глубокого дыхания. Метод ВЛГД ПГПР +косметическое отбеливание
ПГПР +косметическое отбеливание Определение риска ССЗ по системе Score
Определение риска ССЗ по системе Score Анатомия человека. Общая артросиндесмология. Классификация суставов и их основные и вспомогательные элементы
Анатомия человека. Общая артросиндесмология. Классификация суставов и их основные и вспомогательные элементы Клиническая фармакология стероидных и нестероидных противовоспалительных препаратов
Клиническая фармакология стероидных и нестероидных противовоспалительных препаратов Процесс приёма ТМЦ на РЦ(kk) (1)
Процесс приёма ТМЦ на РЦ(kk) (1) Майлардың алмасуынан пайда болатын аурулар
Майлардың алмасуынан пайда болатын аурулар Методы магнитной томографии. Лекция 1
Методы магнитной томографии. Лекция 1 Презентация к выступлению Плюснина
Презентация к выступлению Плюснина История развития психопатологии в России
История развития психопатологии в России ОЗОН – эффективное средство повышения иммунитета!
ОЗОН – эффективное средство повышения иммунитета! Раневая инфекция
Раневая инфекция