Содержание
- 2. ЖОСПАР: III A топша элементтерінің жалпы сипаттамасы Бордың физикалық және химиялык қасиеттері Алюминийдің физикалық және химиялык
- 3. Периодтық жүйенің ІІІА топшасында кең таралған элементтер – В, Al, Ga, In, Tl. ША топша элементтері
- 4. Бордың ашылу тарихы Бордың ашылуы 1808 жыл деп есептелінеді . Оны алғаш ашқан авторлар саны бірнешеу
- 6. Бордың физикалық қасиеттері Бор - қиын балқитын , диамагнитті , қара ( кристалданған ) немесе бурыл
- 7. Химиялық қасиеттері Кристалданған бор химиялық инертті . Оттегімен 750 ° C маңайында әрекеттесіп , В203 түзеді
- 8. Бура - суда жақсы еритін түссіз кристалдар 60,8 ° С - та гидратқа Na2 [ B405
- 9. Алюминийдің ашылу тарихы Алюминийді бос күйінде алғаш рет 1825 жылы даниялық физик Ханс Кристиан Эрстед алған
- 10. Алюминий (лат. Aluminium),– ашудас, Al – элементтердің периодтық жүйесінің ІІІ тобындағы химиялық элемент, реттік нөмірі 13,
- 12. ӨНЕРКӘСІПТЕ АЛЫНУЫ: Алюминийді электролиз әдіспен алуға болады. Алюминий өндірісінде, шикізат ретінде көбінесе боскситтер жиі қолданады. Қыздырғанда
- 13. АЛЮМИНИЙ техникада және тұрмыста кең Қолданылады . Жеңіл және бағалы қасиеттері бар құймалар алынатындықтан , оның
- 14. Маңызы Ересек адам күніне алюминийдің 30-50 мг қажет етеді . Күнделікті Өмірде оны нан өнімдерінен аламыз
- 15. ҚОРЫТЫНДЫ ІІІ топтың негізгі кіші тобы бор , алюминий , галий , индий және таллийден тұрады
- 17. Скачать презентацию
Слайд 2ЖОСПАР:
III A топша элементтерінің жалпы сипаттамасы
Бордың физикалық және химиялык қасиеттері
ЖОСПАР:
III A топша элементтерінің жалпы сипаттамасы
Бордың физикалық және химиялык қасиеттері

Алюминийдің физикалық және химиялык қасиеттері
Қорытынды
Пайдаланылған әдебиеттер
Слайд 3Периодтық жүйенің ІІІА топшасында кең таралған элементтер – В, Al, Ga, In,
Периодтық жүйенің ІІІА топшасында кең таралған элементтер – В, Al, Ga, In,

ША топша элементтері Бейметалл Амфотерлі Периодтық жүйенің IІІА топшасында кең таралған элементтер - B , AI , Galn , TI . Олардың атомдарының сыртқы деңгейінде Зе ѕ2p1болады.Қозбаған күйде р электрон ғана жұптаспаған . Бірақ бұл элементтердің тотығу дәрежесі +3 Д. көрсетеді , өйткені электронды s - тен р - күйге ауыстыру үшін аз энергия қажет . Тек талий көбінсе + 1т.Д . ТӘН . Бұл ТОПшаның барлық элементерінің Э203 типті оксидтер түзуі КӨП мөлшерде жылу бөлумен жүреді . Э ( OH ) 3 типті екідайлы қасиет көрсететін гидроксидтер сәйкес келеді
Слайд 4Бордың ашылу тарихы
Бордың ашылуы 1808 жыл деп есептелінеді . Оны алғаш ашқан
Бордың ашылу тарихы
Бордың ашылуы 1808 жыл деп есептелінеді . Оны алғаш ашқан

Слайд 6Бордың физикалық қасиеттері Бор - қиын балқитын , диамагнитті , қара (
Бордың физикалық қасиеттері Бор - қиын балқитын , диамагнитті , қара (

Слайд 7Химиялық қасиеттері Кристалданған бор химиялық инертті . Оттегімен 750 ° C маңайында
Химиялық қасиеттері Кристалданған бор химиялық инертті . Оттегімен 750 ° C маңайында

Бордың маңызды оттегiлiк қосылыстарына бор Оксиді B2O3 , бор қышқылдары және олардың тұздары бораттар жатады .
Бор оксидінің алынуы : 4B + 302 = 2B203 2H3B03 = B203 + 3H20 Ортобор ( бор ) қышқылы В ( OH ) з немесе НЗВОЗ бордың ерігіш қосылыстарының , мысалы бураның Na2 [ B4O5 ( OH ) 4 ] 8H20 гидролиздену өніміне жатады . Na2 [ B405 ( OH ) 4 ] 8H2O + H2SO4 = 4B ( OH ) 3 + Na2SO4 + 5H20 Бор қышқылы қолға майлы болып сезілетін , балық қабықшаларына ұқсас кристалдар . НВОЗ суда жақсы ериді жэне бір негізді әлсіз қышқылдарға жатады
Слайд 8Бура - суда жақсы еритін түссіз кристалдар 60,8 ° С - та
Бура - суда жақсы еритін түссіз кристалдар 60,8 ° С - та

Қолданылуы Бор термисторлар , термиялық нейтрондардың жартылай өткізгішті есептегіштерінде , нейтрондарды жұтатын материалдардың негізі , қорытпалардың , керамиканың , стакандардың бөлігі болып табылады . Атом өнеркәсібінде бор мен бордың карбидтері пайдаланылады , олар қорғаныш жабындарды жасау үшін қолданылады .
Кездесуі Германия , Америка , Тибет т.б. жерлерде Өндіріске қажетті бр кендері бар . Қазақстанда бор кендері ашарит , борацит , гидроборацит , пандермит т.б. миералдар түрінде кездеседі . Таза кристалды бордың тығыздығы -2340 кг / м3 , балқу температурасы -20750С , қайнау температурасы - 38500С . Бор қаттылығы жағынан алмаздан кейінгі периодтық жүйедегі металдық және бейметалдық элемент . Оның қаттылығы 9,3 - ке тең .
Алынуы Жоғары температурада азотпен әрекеттескенде бор нитридін BN , Көмірмен –бор карбидін B4C , металдармен – боридтер түзеді . Таза аморфты борды Анри Муассан магниeтepМИЯЛЫҚ немесе натритермиялық
Слайд 9Алюминийдің ашылу тарихы
Алюминийді бос күйінде алғаш рет 1825 жылы даниялық физик
Алюминийдің ашылу тарихы
Алюминийді бос күйінде алғаш рет 1825 жылы даниялық физик

Слайд 10 Алюминий (лат. Aluminium),– ашудас, Al – элементтердің периодтық жүйесінің ІІІ тобындағы
Алюминий (лат. Aluminium),– ашудас, Al – элементтердің периодтық жүйесінің ІІІ тобындағы

АЛЮМИНИЙ (ЛАТ. ALUMINIUM),– АШУДАС, AL – ЭЛЕМЕНТТЕРДІҢ ПЕРИОДТЫҚ ЖҮЙЕСІНІҢ ІІІ ТОБЫНДАҒЫ ХИМИЯЛЫҚ ЭЛЕМЕНТ, РЕТТІК НӨМІРІ 13, АТОМДЫҚ МАССАСЫ 26,9815. БІР ТҰРАҚТЫ ИЗОТОПЫ БАР. ЖЕР ҚЫРТЫСЫНДА ТАРАЛУЫ БОЙЫНША ЭЛЕМЕНТТЕР АРАСЫНДА 4, МЕТАЛДАР АРАСЫНДА 1-ШІ ОРЫНДА. ТАБИҒАТТА ЖҮЗДЕГЕН МИНЕРАЛДАРЫ КЕЗДЕСЕДІ, ОНЫҢ КӨПШІЛІГІ – АЛЮМОСИЛИКАТТАР БОЛЫП КЕЛЕДІ. АЛЮМИНИЙ ЛАТЫНША ALUMІNІUM; АЛЮМИНИЙ АЛУ ҮШІН ПАЙДАЛАНЫЛАТЫН НЕГІЗГІ ШИКІЗАТ – БОКСИТ.
Алюминийді бос күйінде алғаш рет 1825 жылы даниялық физик Ханс Кристиан Эрстед алған. Алюминий – күміс түсті ақ металл, жылуды және электр тогын жақсы өткізеді, созуға, соғуға икемді, меншікті салмағы 2,7 г/см3; балқу температурасы 660ӘС, қайнау температурасы 2500ӘС; коррозияға берік, қалыпты температурада тұрақты, себебі бетіндегі алюминий оксидінен тұратын жұқа қабыршақ оны тотығудан қорғайды. Сондай-ақ ол амфотерлі элемент, сондықтан қышқылдармен де,
сілтілермен де әрекеттеседі.
Слайд 12ӨНЕРКӘСІПТЕ АЛЫНУЫ:
Алюминийді электролиз әдіспен алуға болады. Алюминий өндірісінде, шикізат ретінде көбінесе боскситтер
ӨНЕРКӘСІПТЕ АЛЫНУЫ:
Алюминийді электролиз әдіспен алуға болады. Алюминий өндірісінде, шикізат ретінде көбінесе боскситтер

AI2O3 электролиз→ 2AI+1.5O2
Слайд 13 АЛЮМИНИЙ техникада және тұрмыста кең Қолданылады . Жеңіл және бағалы қасиеттері
АЛЮМИНИЙ техникада және тұрмыста кең Қолданылады . Жеңіл және бағалы қасиеттері

Кездесуі Алюминий кеңдерінің бай қорлары Қазақстанда , Оралда , Хибин тауларында , Башкирияда , Сібірде кездеседі . Боксит - Al2O3 - nH2O Қазақстанда бокситтердің белгілі кен орындары бар . Олар Қостанай және Ақтөбе облыстарында орналасқан . Павлодар алюминий зауытында металл күйіндегі алюминий өндіріледі.
Слайд 14Маңызы Ересек адам күніне алюминийдің 30-50 мг қажет етеді . Күнделікті Өмірде
Маңызы Ересек адам күніне алюминийдің 30-50 мг қажет етеді . Күнделікті Өмірде

Слайд 15ҚОРЫТЫНДЫ
ІІІ топтың негізгі кіші тобы бор , алюминий , галий ,
ҚОРЫТЫНДЫ
ІІІ топтың негізгі кіші тобы бор , алюминий , галий ,



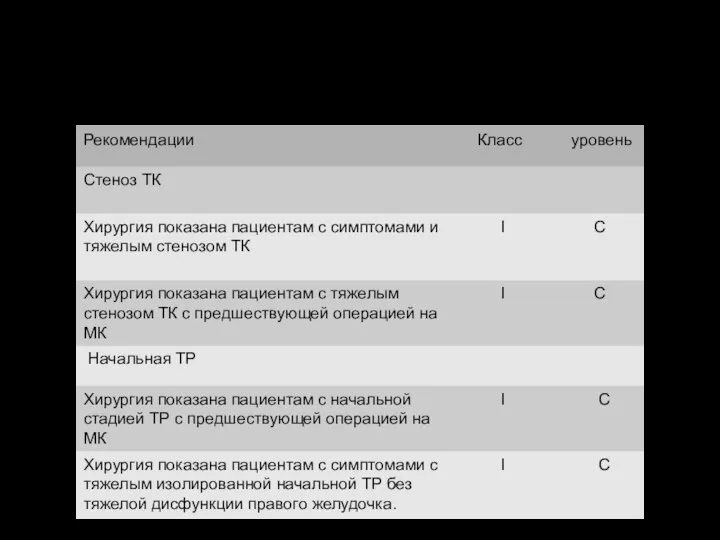 Показания для протезирования трехстворчатого клапана
Показания для протезирования трехстворчатого клапана Хейлопластикаға көрсеткіш,реабилитация, диспансеризация
Хейлопластикаға көрсеткіш,реабилитация, диспансеризация ЛФК при переломах длинных трубчатых костей
ЛФК при переломах длинных трубчатых костей Лечебная физическая культура
Лечебная физическая культура Хронический панкреатит
Хронический панкреатит Жүре және туа пайда болған липидоздар
Жүре және туа пайда болған липидоздар Целительство. Зелье. Урок первый
Целительство. Зелье. Урок первый Наследственные синдромы, сопровождающиеся низким ростом
Наследственные синдромы, сопровождающиеся низким ростом Лечебная физкультура при синдроме вегетативной дисфункции
Лечебная физкультура при синдроме вегетативной дисфункции Метоболизмдік синдромы бар пациенттерде когнитивті қызмет жағдайы
Метоболизмдік синдромы бар пациенттерде когнитивті қызмет жағдайы Пищевые отравления
Пищевые отравления Основные заболевания, приводящие к дефициту самообслуживания
Основные заболевания, приводящие к дефициту самообслуживания Современные подходы к профилактике и лечению инфекций в акушерстве и гинекологии
Современные подходы к профилактике и лечению инфекций в акушерстве и гинекологии Стоматит. Виды стоматита
Стоматит. Виды стоматита Швы кожи
Швы кожи Вклад Джозефа Листера в хирургию. Развитие методов асептики и антисептики
Вклад Джозефа Листера в хирургию. Развитие методов асептики и антисептики Полипренолы – природный фактор регенерации живых клеток
Полипренолы – природный фактор регенерации живых клеток Опиоидные аналгетики
Опиоидные аналгетики Биохимия обестатина
Биохимия обестатина Фотопротокол. Дентальная фотография
Фотопротокол. Дентальная фотография Нейрон. Морфофункциональная поляризация нейрона
Нейрон. Морфофункциональная поляризация нейрона Общая эпидемиология
Общая эпидемиология Виды суставов. Виды костей. Лабораторная работа
Виды суставов. Виды костей. Лабораторная работа Трихомониаз
Трихомониаз Число 9. Девятый
Число 9. Девятый Изменение цвета зубов в процессе формирования вследствие порфирии
Изменение цвета зубов в процессе формирования вследствие порфирии Лечение заболеваний твердых тканей зуба
Лечение заболеваний твердых тканей зуба Современная классификация ран. Течение раневого процесса. Принципы лечения чистых ран
Современная классификация ран. Течение раневого процесса. Принципы лечения чистых ран