Содержание
- 3. Наследственная недостаточность α1антитрипсина (α1АТ) – генетическое заболевание, клинически проявляющееся эмфиземой легких, циррозом печени и значительно реже
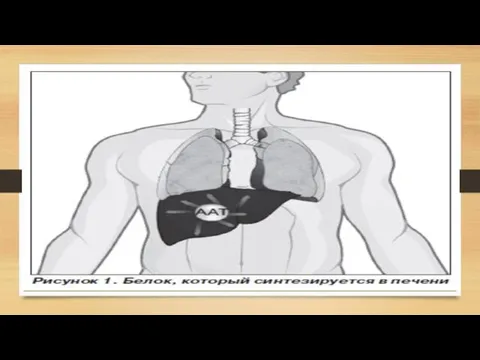
- 4. Общие сведения об альфа-1-антитриписине А1АТ представляет собой низкомолекулярный гликопротеин, состоящий из 394 аминокислотных остатков и трех
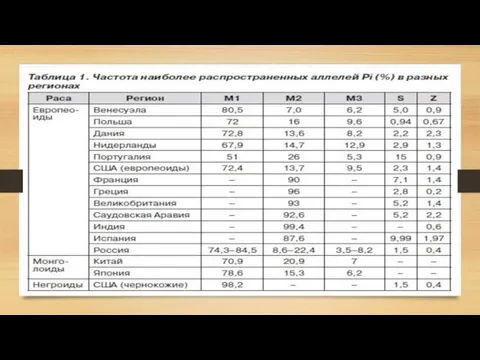
- 5. Генетический полиморфизм альфа-1-антитриписина За продукцию А1АТ отвечает ген, расположенный на хромосоме 14q32.1, называемый SERPINA1 (serpin peptidase
- 6. Есть несколько форм и степеней дефицита, которые главным образом зависят от того, сколько (1 или 2
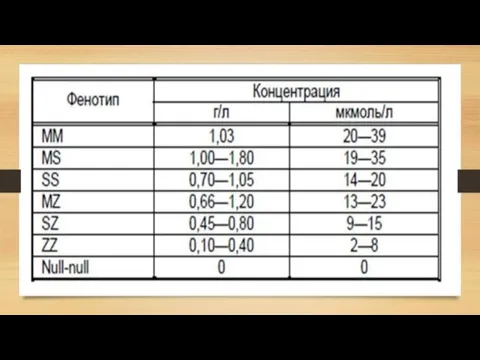
- 8. Варианты наследования гена альфа-1-антитрипсина ММ — оба варианта гена здоровы MS или MZ (PiMS, PiMZ) —
- 14. Риск развития эмфиземы значительно возрастает при снижении уровня сывороточного А1-АТ менее 0,8 г/л (11 ммоль/л) (норма
- 15. Уровень альфа-1-антитриписина в норме и физиологические колебания. Наибольшие количества А1АТ содержатся в сыворотке крови, обеспечивая 90%
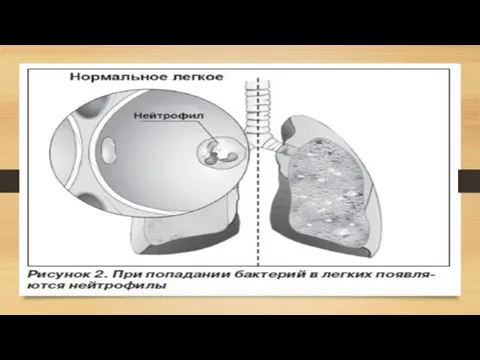
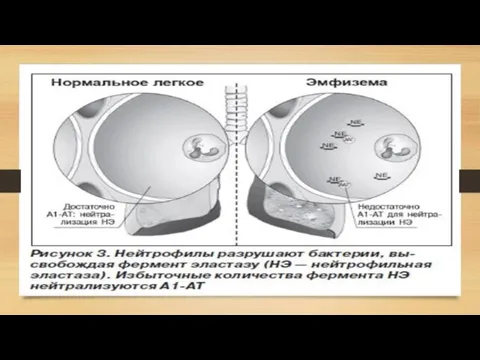
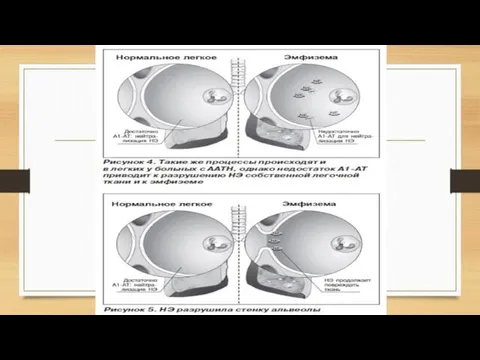
- 16. Эмфизема (с греческого – «надувать, разбухать») – заболевание легких, характеризующееся патологическим расширением полостей. Легкое становится объемным
- 17. Клиника Среди основных симптомов дефицита альфа-1-антитрипсина необходимо выделить следующие: одышка, свистящее дыхание и сухие свистящие хрипы
- 18. Диагностика Заболевание диагностируется очень редко. В большинстве случаев, больные альфа-1-антитрипсином безуспешно лечатся с неверными диагнозами —
- 19. Несмотря на довольно широкую распространенность недостаточности А1АТ и несомненные преимущества ее ранней диагностики, лишь в десятке
- 20. Лечение дефицита альфа-1-антитрипсина Специфических методов лечения не существует. Для предупреждения прогрессирования заболевания необходимо избегать неблагоприятного воздействия
- 22. Скачать презентацию
Слайд 3 Наследственная недостаточность α1антитрипсина (α1АТ) – генетическое заболевание, клинически проявляющееся эмфиземой легких,
Наследственная недостаточность α1антитрипсина (α1АТ) – генетическое заболевание, клинически проявляющееся эмфиземой легких,

Слайд 4 Общие сведения об альфа-1-антитриписине
А1АТ представляет собой низкомолекулярный гликопротеин, состоящий из
Общие сведения об альфа-1-антитриписине
А1АТ представляет собой низкомолекулярный гликопротеин, состоящий из

минут.
Слайд 5 Генетический полиморфизм альфа-1-антитриписина
За продукцию А1АТ отвечает ген, расположенный на хромосоме
Генетический полиморфизм альфа-1-антитриписина
За продукцию А1АТ отвечает ген, расположенный на хромосоме

Слайд 6 Есть несколько форм и степеней дефицита, которые главным образом зависят от
Есть несколько форм и степеней дефицита, которые главным образом зависят от

Слайд 8Варианты наследования гена альфа-1-антитрипсина
ММ — оба варианта гена здоровы
MS или MZ (PiMS,
Варианты наследования гена альфа-1-антитрипсина
ММ — оба варианта гена здоровы
MS или MZ (PiMS,

SS (PiSS) — без симптомов или незначительные проявления дефицита альфа-1-антитрипсина, синтезируется около 60% необходимого количества белка
SZ (PiSZ) — повышен риск эмфиземы легких, в крови только 40% необходимого антитрипсина
ZZ (PiZZ) — наиболее тяжелая форма дефицита, 10% от нормы
Слайд 14Риск развития эмфиземы значительно возрастает при снижении уровня сывороточного А1-АТ менее 0,8
Риск развития эмфиземы значительно возрастает при снижении уровня сывороточного А1-АТ менее 0,8

Слайд 15 Уровень альфа-1-антитриписина в норме и физиологические колебания.
Наибольшие количества А1АТ содержатся
Уровень альфа-1-антитриписина в норме и физиологические колебания.
Наибольшие количества А1АТ содержатся

Слайд 16 Эмфизема (с греческого – «надувать, разбухать») – заболевание легких, характеризующееся патологическим
Эмфизема (с греческого – «надувать, разбухать») – заболевание легких, характеризующееся патологическим

Легкие
Примечательно, что обычно эмфизема и ХОБЛ возникают у тех пациентов, которые регулярно подвергают свои легкие воздействию вредных факторов: дыму от сигарет или вдыханию частиц промышленных отходов, которые оседают в легких и повреждают их. Но если эмфизема или ХОБЛ возникает у пациента, который не курит и живет в хороших экологических условиях – то это признак дефицита А1АТ. Химические испытания показали, что сигаретный дым окисляет аминокислоту метионин, входящий в состав А1АТ и «деформируют» его структуру, что вызывает эмфизему.
Чем ниже уровень альфа-1-антитрипсина, тем выше риск развития эмфиземы.
Печень
Дефект гена, кодирующего структуру А1АТ, способствует продукции дефектного фермента А1АТ, который не может полноценно утилизироваться клетками печени. Как следствие, в печени накапливается этот фермент и повреждает орган: развивается фиброз, а затем и цирроз печени. Данная патология больше распространена в детском возрасте, чем во взрослом.
Слайд 17 Клиника
Среди основных симптомов дефицита альфа-1-антитрипсина необходимо выделить следующие: одышка, свистящее
Клиника
Среди основных симптомов дефицита альфа-1-антитрипсина необходимо выделить следующие: одышка, свистящее

Дефицит α1-антитрипсина имеет значение для возникновения и прогрессирования следующих заболеваний: - Цирроз печени; - ХОБЛ; - Пневмоторакс (особенно спонтанный у больных с эмфиземой легких); - Астма; - Синдром Вегенера; - Панкреатит; - Желчный камень; - Бронхоэктатическая болезнь; - Тазовый пролапс органов; - Первичный склерозирующий холангит; - Аутоиммунный гепатит; - Эмфизема, которая преимущественно возникает в нижней части легких и вызывает возникновение булл; - Гепатоцеллюлярная карцинома (рак печени); - Рак мочевого пузыря; - Рак желчного пузыря; - Лимфома; - Рак легких;
Слайд 18Диагностика
Заболевание диагностируется очень редко. В большинстве случаев, больные альфа-1-антитрипсином безуспешно лечатся
Диагностика
Заболевание диагностируется очень редко. В большинстве случаев, больные альфа-1-антитрипсином безуспешно лечатся

Диагноз устанавливается на основании анамнеза, жалоб, характерных симптомов — одышка, кашель, нарушение дыхания (учащение либо урежение, изменение ритма), отсутствия эффекта от проводимой терапии легочных заболеваний. Определение уровня α1-Антитрипсина в крови (в норме 1,4—3,2 г/л, при данном заболевании уровень снижается).
Генетическое обследование — выявляются характерные мутации (изменения в структуре хромосом), которые в зависимости от степени дефицита α1-Антитрипсина шифруются как: PiMM: 100% (нормальный), PIMS (80% от нормального уровня), PiSS (60% от нормального уровня), PiMZ (60%), PiSZ (40%), PiZZ (10-15%).
Возможна также консультация гастроэнтеролога, пульмонолога, медицинского генетика. анализ уровня альфа-1-антитрипсина в крови.
Слайд 19Несмотря на довольно широкую распространенность недостаточности А1АТ и несомненные преимущества ее ранней
Несмотря на довольно широкую распространенность недостаточности А1АТ и несомненные преимущества ее ранней

Слайд 20 Лечение дефицита альфа-1-антитрипсина
Специфических методов лечения не существует. Для предупреждения прогрессирования заболевания
Лечение дефицита альфа-1-антитрипсина
Специфических методов лечения не существует. Для предупреждения прогрессирования заболевания

-отказ от курения (в том числе “ пассивного” — вдыхание табачного дыма от сигарет, которые курят окружающие);
-избегать контакта с загрязненным воздухом (например, дорожная пыль, стройки);
-в случае проживания в мегаполисе с плохой экологической обстановкой – рекомендуется сменить место жительства (желательно, на сельскую местность);
-соблюдение диеты №5 (ограничение жирного, жареного, белков и др.);
-отказ от алкоголя;
-ограничение физических нагрузок (только лечебная физкультура).
Симптоматическая терапия:
-гепатопротекторные препараты (улучшают функцию печени);
-дыхательная гимнастика (раздел лечебной физкультуры, сочетающий в себе выполнение физических упражнений (наклонов, приседаний и пр.) с определенным дыхательным ритмом (например, во время наклона вперед усиленный, громкий выдох));
-кислородотерапия (в тяжелых случаях, при ухудшении состояния — подача кислорода больному через кислородную маску или с помощью аппарата ИВЛ (Искусственной Вентиляции Легких)).
В некоторых странах проводится лечение дефицита α1-Антитрипсина путем заместительной терапии — внутривенного введения α1-Антитрипсина, выделенного из донорской крови. Однако такая терапия усугубляет нарушения печени (в ней откладывается еще большее количество α1-Антитрипсина). При развитии цирроза печени (гибель клеток печени и их замещение бесполезной соединительной тканью, приводящее к полному нарушению функции печени) и эмфиземы легких (“ вздутие” легких из-за патологического расширения мелких бронхов (бронхиол) и альвеолл, приводящее к полному нарушению функции легких), при данном заболевании продлить жизнь больному может только трансплантация печени и легких.
 Энтеробактерии. Сальмонеллы возбудители брюшного тифа и паратифов
Энтеробактерии. Сальмонеллы возбудители брюшного тифа и паратифов Жизнь без ВИЧ - твой выбор
Жизнь без ВИЧ - твой выбор Уход за кистями рук и ногтями
Уход за кистями рук и ногтями Минеральные вещества
Минеральные вещества Польза секса для здоровья
Польза секса для здоровья Раны. Виды ран
Раны. Виды ран Патофизиология жирового обмена
Патофизиология жирового обмена Аутичный ребенок: пути помощи
Аутичный ребенок: пути помощи Евгеника. Евгеника түрлері. Евгеника және қазіргі заман
Евгеника. Евгеника түрлері. Евгеника және қазіргі заман Определение понятий кислородный запрос, максимальное потребление кислорода
Определение понятий кислородный запрос, максимальное потребление кислорода Нормальная микрофлора организма. Механизмы передачи инфекции
Нормальная микрофлора организма. Механизмы передачи инфекции Efektīvākā terapija
Efektīvākā terapija Центр медицинского массажа и косметологии
Центр медицинского массажа и косметологии Препарирование под металлокерамику
Препарирование под металлокерамику Исследование природных факторов, влияющих на уровень здоровья учащихся общеобразовательных школ производственная практика (нир)
Исследование природных факторов, влияющих на уровень здоровья учащихся общеобразовательных школ производственная практика (нир) Диагностика и коррекция психических расстройств в работе психолога
Диагностика и коррекция психических расстройств в работе психолога Ожирение и беременность
Ожирение и беременность Диагностическое значение онкомаркеров в ранней диагностике рака
Диагностическое значение онкомаркеров в ранней диагностике рака Повышение эффективности и механизмы реализации социальных проектов в сфере здравоохранения региона
Повышение эффективности и механизмы реализации социальных проектов в сфере здравоохранения региона Колоректальная хирургия
Колоректальная хирургия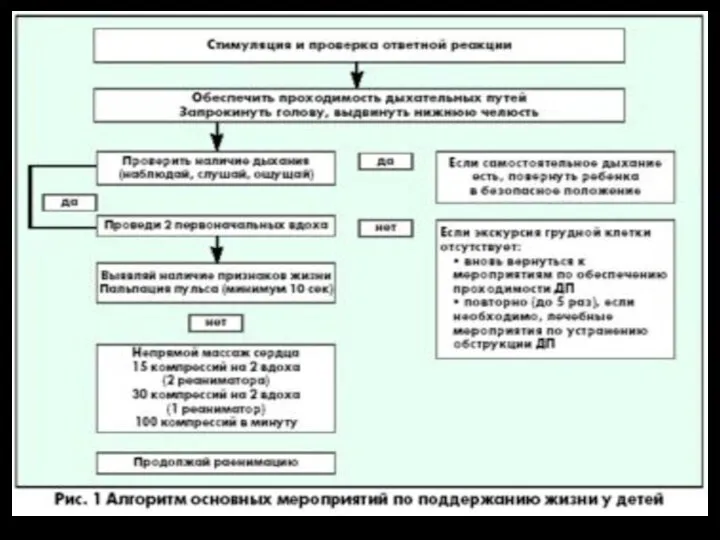 Особенности СЛР у детей
Особенности СЛР у детей Гипертензиялар
Гипертензиялар Гемолитическая болезнь новорожденных. Формы болезни
Гемолитическая болезнь новорожденных. Формы болезни Психотипы пациентов и способы взаимодествия с ними
Психотипы пациентов и способы взаимодествия с ними Инструментальные методы исследования
Инструментальные методы исследования Спелеотерапия
Спелеотерапия Selected trends and some insights in prevention
Selected trends and some insights in prevention Герпесвирусные инфекции V, VI, VII, VIII типов
Герпесвирусные инфекции V, VI, VII, VIII типов