Содержание
- 2. Резюме статьи отражает: Обоснование и цель Дизайн исследования Критерии и Участники Вмешательство Исход Результаты Ограничения Выводы
- 3. Введение (Introduction) Проблема: Анемия является общей чертой хронической болезни почек. Анемия становится все более распространенным и
- 4. Многоцентровое двойное слепое рандомизированное плацебо-контролируемое исследование, проведенное в 30 центрах в Соединенных Штатах Америки Дизайн исследования
- 5. Пациенты (критерии включения) В исследовании участвовали пациенты не моложе 18 лет, которые имели ХБП со скоростью
- 6. Пациенты (критерии исключения/невключения) Критерии исключения: Пациенты с другими формами анемии Пациенты недавно получавшие добавки железа, стимуляторы
- 7. Фазы и вмешательство Исследование состояло из фазы двойного слепого лечения и открытой фазы. 167 взрослых были
- 8. Рекомендации по приему Пациентам было предписано принимать капсулы с водой утром перед завтраком и вечером непосредственно
- 9. Первичная и вторичные конечные точки Первичная конечная точка - изменение уровня гемоглобина от исходного уровня в
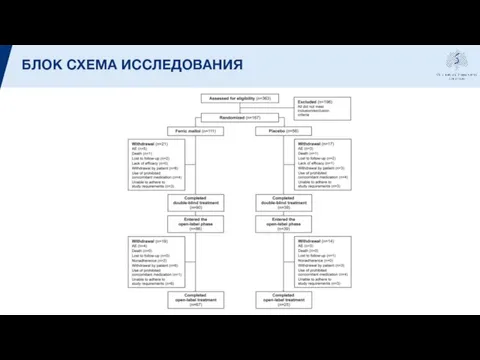
- 10. БЛОК СХЕМА ИССЛЕДОВАНИЯ
- 11. Результаты
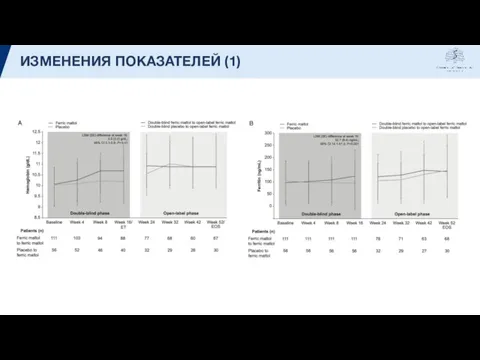
- 12. ИЗМЕНЕНИЯ ПОКАЗАТЕЛЕЙ (1)
- 13. ИЗМЕНЕНИЯ ПОКАЗАТЕЛЕЙ (2)
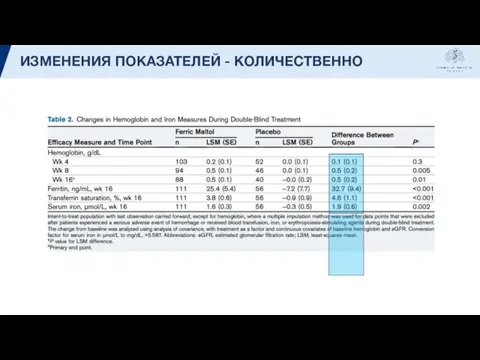
- 14. ИЗМЕНЕНИЯ ПОКАЗАТЕЛЕЙ - КОЛИЧЕСТВЕННО
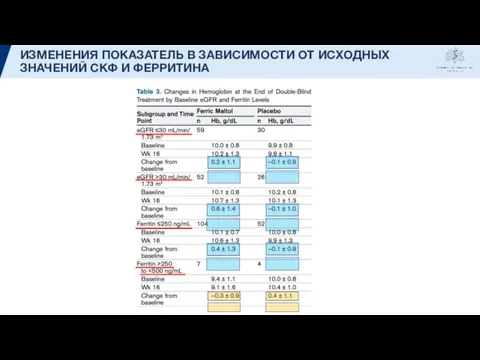
- 15. ИЗМЕНЕНИЯ ПОКАЗАТЕЛЬ В ЗАВИСИМОСТИ ОТ ИСХОДНЫХ ЗНАЧЕНИЙ СКФ И ФЕРРИТИНА
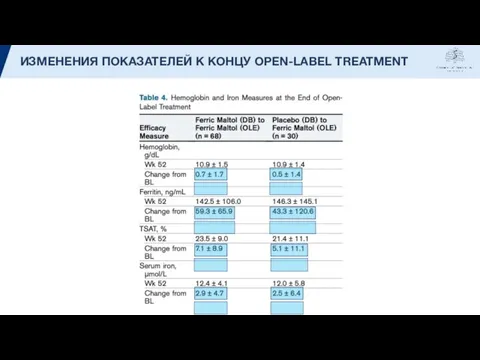
- 16. ИЗМЕНЕНИЯ ПОКАЗАТЕЛЕЙ К КОНЦУ OPEN-LABEL TREATMENT
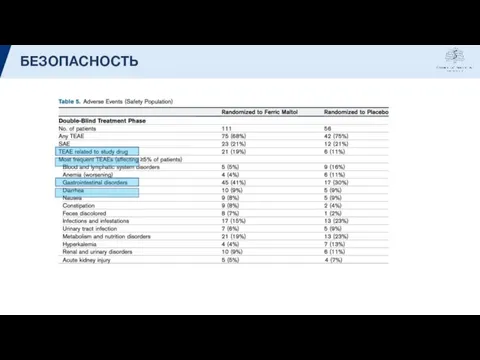
- 17. БЕЗОПАСНОСТЬ
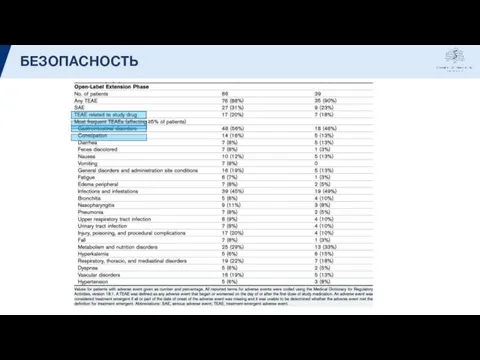
- 18. БЕЗОПАСНОСТЬ
- 19. ВЫБЫВАНИЕ ИЗ ИССЛЕДОВАНИЯ И СЕРЬЕЗНЫЕ НЕБЛАГОПРИЯТНЫЕ ИСХОДЫ; DOUBLE-BLIND PHASE Погибли 2 пациента: 1 – в группе
- 20. ВЫБЫВАНИЕ ИЗ ИССЛЕДОВАНИЯ И СЕРЬЕЗНЫЕ НЕБЛАГОПРИЯТНЫЕ ИСХОДЫ; OPEN-LABLE PHASE Во время open-label phase не было смертельных
- 21. ОБСУЖДЕНИЯ «В этом рандомизированном, двойном слепом плацебо-контролируемом исследовании у пациентов с ХБП 3 или 4 стадии
- 22. ОБСУЖДЕНИЯ Долгосрочное лечение во время дальнейшей open-label phase показало, что продолжение перорального ferric maltol поддерживало достигнутые
- 23. ОГРАНИЧЕНИЯ ИССЛЕДОВАНИЯ Гетерогенность базовых уровней ферритина - хотя и в соответствии с руководящими принципами KDOQI и
- 24. Заключение Ferric maltol был связан со статистически значимым (16-я неделя) и устойчивым (до 52 недели) увеличением
- 26. Скачать презентацию
















 Глубокие ожоги IIIB – IV степень
Глубокие ожоги IIIB – IV степень Бронхиальная астма (БА)
Бронхиальная астма (БА) Синдром преждевременной недостаточности яичников
Синдром преждевременной недостаточности яичников Нейро-лінгвістичне програмування як засіб програмування особистості
Нейро-лінгвістичне програмування як засіб програмування особистості Коронавирус (Covid-19)
Коронавирус (Covid-19) СП при гепатитах
СП при гепатитах HPV и рак шейки матки
HPV и рак шейки матки Мед.катастроф Лекция №10 травма груди
Мед.катастроф Лекция №10 травма груди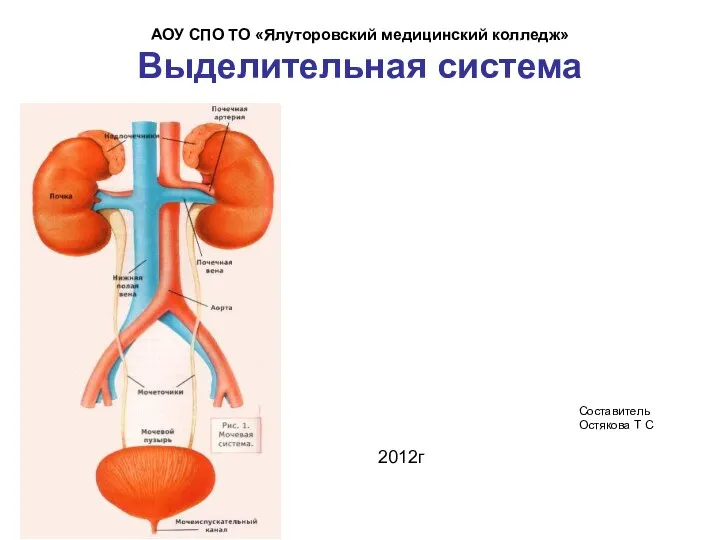 Выделительная система
Выделительная система Пневмония. Этиология. Патогенез
Пневмония. Этиология. Патогенез Синдромы аффективной патологии
Синдромы аффективной патологии Как попасть в страну здоровья ?
Как попасть в страну здоровья ? Физическое здоровье
Физическое здоровье Заболевание глаз
Заболевание глаз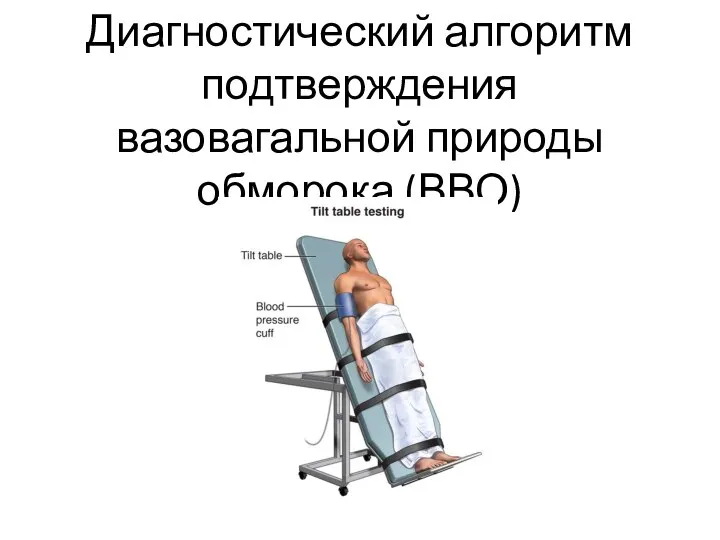 Диагностический алгоритм подтверждения вазовагальной природы обморока (ВВО)
Диагностический алгоритм подтверждения вазовагальной природы обморока (ВВО) Modern COVID-19. Vaccines. Kimberly Meg Pereira (ОрГМУ) 309и
Modern COVID-19. Vaccines. Kimberly Meg Pereira (ОрГМУ) 309и Профилактика, диагностика и лечение туберкулеза
Профилактика, диагностика и лечение туберкулеза Disorders of the Cornea, Sclera and Orbit
Disorders of the Cornea, Sclera and Orbit Коронавирус. Как распространяется вирус?
Коронавирус. Как распространяется вирус? Блокада плечевого сплетения
Блокада плечевого сплетения Школа здоровья для беременных. Занятие 3. Как себя вести: вопросы и ответы
Школа здоровья для беременных. Занятие 3. Как себя вести: вопросы и ответы Мегалобластные и аутоиммунная гемоллитическая анемия
Мегалобластные и аутоиммунная гемоллитическая анемия Клинический случай. Генерализованный атеросклероз. Эверсионная каротидная эндартерэктомия
Клинический случай. Генерализованный атеросклероз. Эверсионная каротидная эндартерэктомия Технология составления комплексных программ реабилитации
Технология составления комплексных программ реабилитации OZ
OZ Опыт органосохраняющих оперций при раке молочной железы в ОБУЗ КОКОД
Опыт органосохраняющих оперций при раке молочной железы в ОБУЗ КОКОД Лабораторная медицина. Стандартизация и способ сбора образцов кала
Лабораторная медицина. Стандартизация и способ сбора образцов кала Устройство и функции ЦСО
Устройство и функции ЦСО