Слайд 2Состав эмали (по Е. В. Боровскому):
Минеральные соли (96-97%):
— гидроксиапатит Ca10(PO4)6(OH)2 – 75,04%
—

карбонатапатит – 12,06%
хлорапатит – 4,39%
фторапатит – 0,63%
карбонат кальция – 1,33%
карбонат магния – 1,62%
ИТОГО, в эмали кальций – 37%, фосфор – 17%
Слайд 3Состав эмали
Органическая основа эмали (1,2%):
белки – 50%
липиды (триглицериды, холестерин, лецитины) – 42%
следы

углеводов
Вода (3,8%).
Слайд 4
Причины возникновения флюоороза
При высоких концентрациях фтора кристаллы фторапатита не образуются а происходит

следующее:
Ca10(PO4)6(OH)2 + 20F- = 10CaF2 + 6PO43- + 2OH-
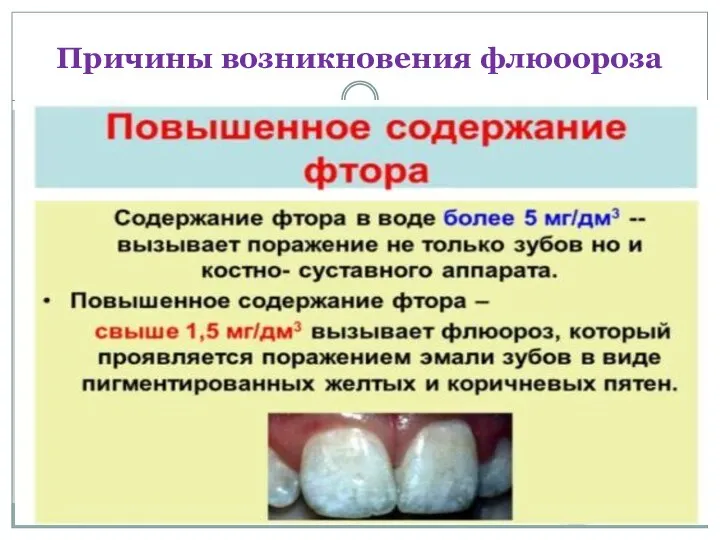
CaF2 – прочный, твердый, но легко выщелачивается. Заболевание, развивающееся при избыточной концентрации фтора в зубах и костях называется флюорозом.
Слайд 5Идеальное соотношение Са/Р=1,67. Оно непостоянно и может изменяться от действия различных факторов.

Ионы Са могут замещаться на близкие по химическим свойствам элементы Ва, Cr, Mg. При этом снижается соотношение Са/Р, что способствует разрушению эмали.
OH- - гидроксиапатита может замещаться на F- в результате образуется другой минерал фторапатит, который превосходит по прочности гидроксиапатит и более устойчив к действию кислот.
Ca10(PO4)6(OH)2 + F- = Ca10(PO4)6FOH + OH-
(Гидроксифторапатит)
Ca10(PO4)6(OH)2 + 2F- = Ca10(PO4)6F2 + 2OH (Фторапатит)
Слайд 6Причины возникновения флюоороза
Слайд 7Роль кальция и фосфата.
Ионы кальция и фосфата могут отчасти пополнить околозубную среду

естественным образом (при снижении рН распадаются мицеллы слюны, растворяются компоненты зубных отложений и апатиты эмали), однако при значительном продолжительном снижении рН этих источников оказывается недостаточно. Сократить утраты минералов из эмали и поощрить их преципитацию из околозубной среды можно, если извне привнести «в зону боев» нужные для перенасыщенности среды ионы – ионы кальция и фосфата из пищевых продуктов (например, сыра) и/или профилактических препаратов. В этом случае можно надеяться на формирование тех или иных соединений кальция и фосфата,
которые могут постепенно модифицироваться до формы апатита (аморфный фосфат кальция Ca9(PO4)6 хH2O (АСР)3→ фосфат октакальция Ca8H2(PO4)6 5H2O (ОСР) → дигидрат фосфата дикальция (син. брушит) CaHPO4 2H2O (DCPD) → гидроксиапатит Ca10 (PO4)6 (OH)2) (НАР).
Слайд 8Роль фторида в кариозном процессе и растворение апатитов.
Сегодня полагают, что основные

механизмы участия фторида в защите от кариеса связаны с его влиянием на процессы растворения и репреципитации минералов эмали. Фторид снижает скорость растворения эмали в условиях кариесогенной ситуации, что объясняют несколькими механизмами. Основное значение придают тому, что ионы фтора могут включаться в апатитную решетку, замещая ионы гидроксила. В результате между узлами кристаллической решетки формируются более тесные связи и, соответственно, структура стабилизируется, становясь более устойчивой к растворению в кислоте. Фторированные апатиты могут формироваться преэруптивно (при достаточном уровне фторида в тканевой жидкости, омывающей фолликул зуба) и постэруптивно – в твердой фазе (ионы фторида из раствора могут самостоятельно или в виде HF проникать в межкристаллические пространства и включаются в кристаллы с исходно вакантными позициями или с частичной утратой гидроксил-ионов) и в жидкой фазе, с последующей преципитацией в частично растворенные кристаллы (см. далее). Из химии известно, что стехиометрические фторапатиты более устойчивы к кислоте, чем гидроксиапатиты (растворяются при рН=4,5 и рН=4,5 соответственно) - этим тезисом и объясняют защитную роль структурного фторапатита
Слайд 9Кроме того, отмечено, что наличие ионов фторида в межкристаллической жидкости стимулирует рост

кристаллов апатита, что повышает уровень минерализации эмали. Ионы фторида, присутстствующие в околозубной среде, отчасти связывают ионы водорода, контролируя рН. Наконец, если околозубная среда перенасыщена по фториду, фторапатиты эмали не растворяются.








 Роль фельдшера в проведении лечебных и профилактических мероприятий в борьбе с гипертонической болезнью
Роль фельдшера в проведении лечебных и профилактических мероприятий в борьбе с гипертонической болезнью Здоровый образ жизни
Здоровый образ жизни Пулороз (Тиф птиці)
Пулороз (Тиф птиці) Diagnostické a léčebné postupy u poranění břicha
Diagnostické a léčebné postupy u poranění břicha Нанобиотехнологии: Полимерные мицеллы
Нанобиотехнологии: Полимерные мицеллы ВСД (НЦД), гипотония
ВСД (НЦД), гипотония Реанимация животных
Реанимация животных Тропические болезни - новая медико-биологическая проблема сибирского региона
Тропические болезни - новая медико-биологическая проблема сибирского региона Уход за детьми с заболеваниями органов пищеварения
Уход за детьми с заболеваниями органов пищеварения Современные методы обследования травматологических больных (инструментальные обследования)
Современные методы обследования травматологических больных (инструментальные обследования) Недостаточность кровообращения. Лекция для студентов 3 курса
Недостаточность кровообращения. Лекция для студентов 3 курса Волчанка. Системная красная волчанка
Волчанка. Системная красная волчанка Маршевый перелом (болезнь Дейчлендера)
Маршевый перелом (болезнь Дейчлендера) Респираторные вирусы и энтеровирусы
Респираторные вирусы и энтеровирусы СПИД – сведи вероятность к нулю!
СПИД – сведи вероятность к нулю! Патологический синдром рабдомиолиз
Патологический синдром рабдомиолиз Приверженность АРВТ
Приверженность АРВТ Риккетсии и хламидии
Риккетсии и хламидии Диффузные болезни соединительной ткани
Диффузные болезни соединительной ткани Әсемділікті қалыптастыратын факторлар
Әсемділікті қалыптастыратын факторлар Дифференциальная диагностика вялотекущих шизофренических процессов и неврастенических расстройств
Дифференциальная диагностика вялотекущих шизофренических процессов и неврастенических расстройств Анестезиологическое обеспечение хирургических вмешательств
Анестезиологическое обеспечение хирургических вмешательств Лучший медицинский работник года со средним профессиональным образованием
Лучший медицинский работник года со средним профессиональным образованием Решение клинических кейсов диспансерное наблюдение детей с заболеваниями органов дыхания
Решение клинических кейсов диспансерное наблюдение детей с заболеваниями органов дыхания Апарат штучної вентиляції легень "ОБЕРІГ"-2010
Апарат штучної вентиляції легень "ОБЕРІГ"-2010 Желудочная диспепсия – синдром ленивого желудка
Желудочная диспепсия – синдром ленивого желудка Студенческий медицинский отряд Астра
Студенческий медицинский отряд Астра Препараты применяемые в детской гастроэнтрологии
Препараты применяемые в детской гастроэнтрологии