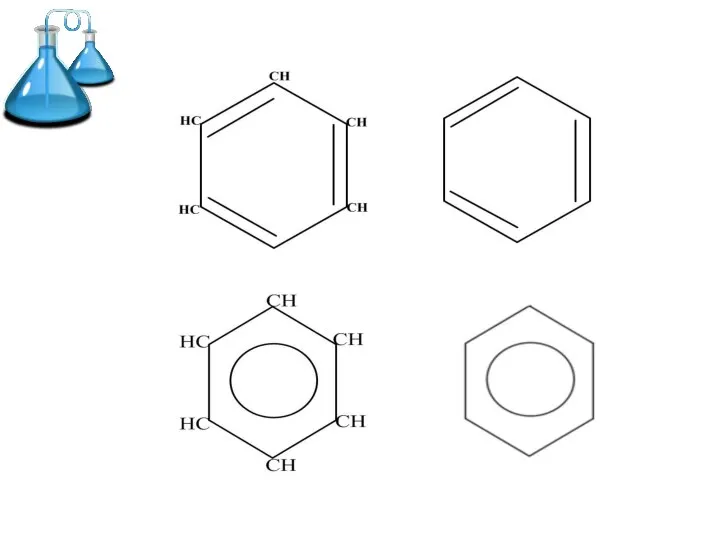
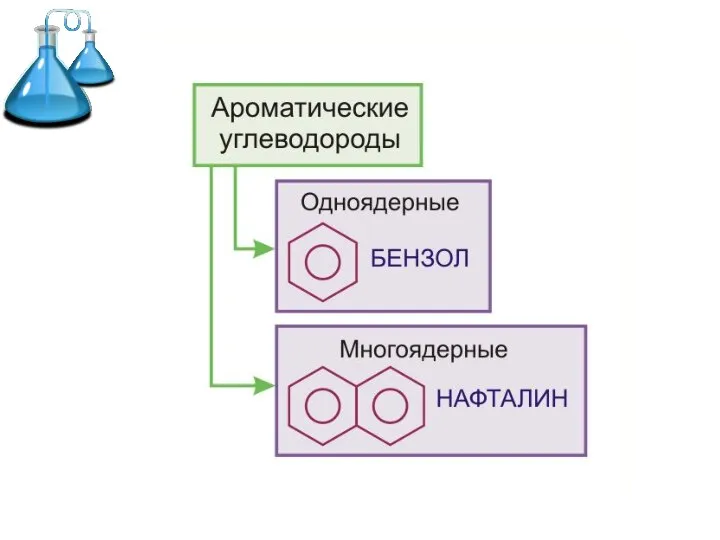
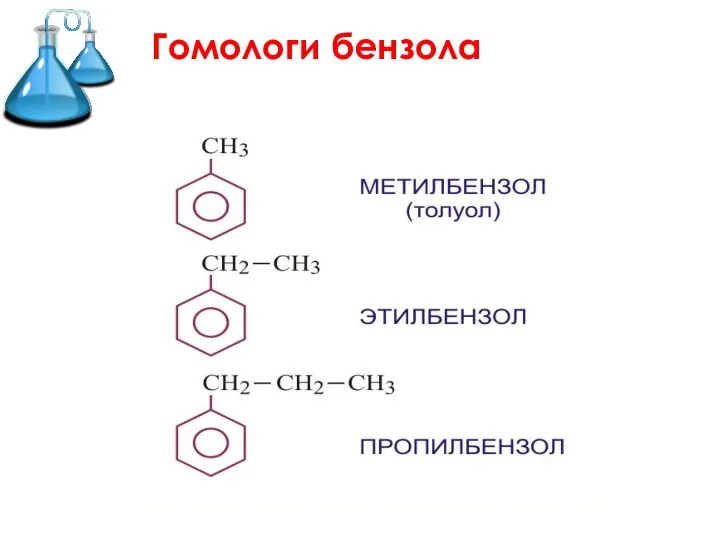
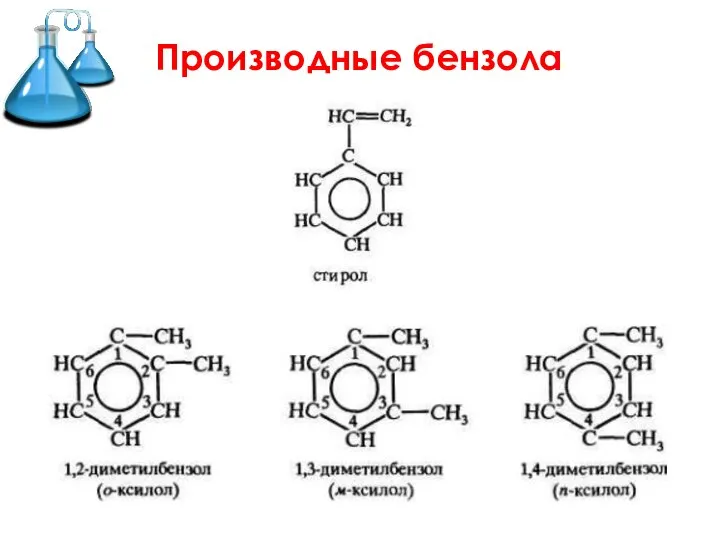
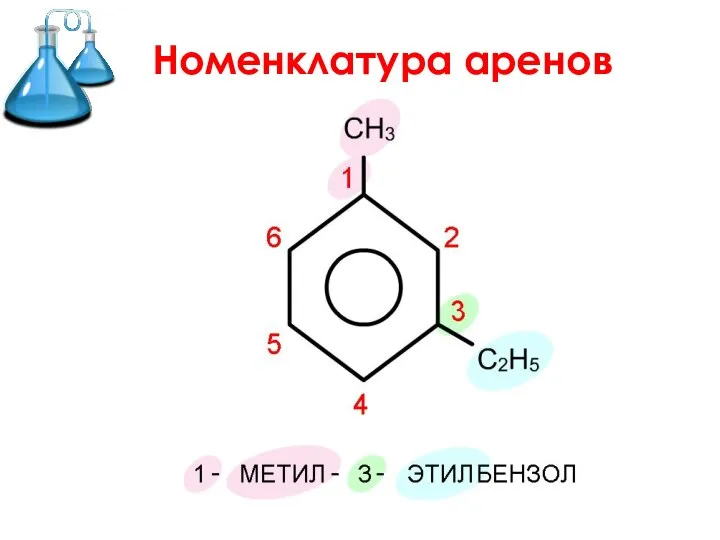
Слайд 2 Ароматические углеводороды (арены) –
это углеводороды с общей формулой СnH2n-6,
в молекулах
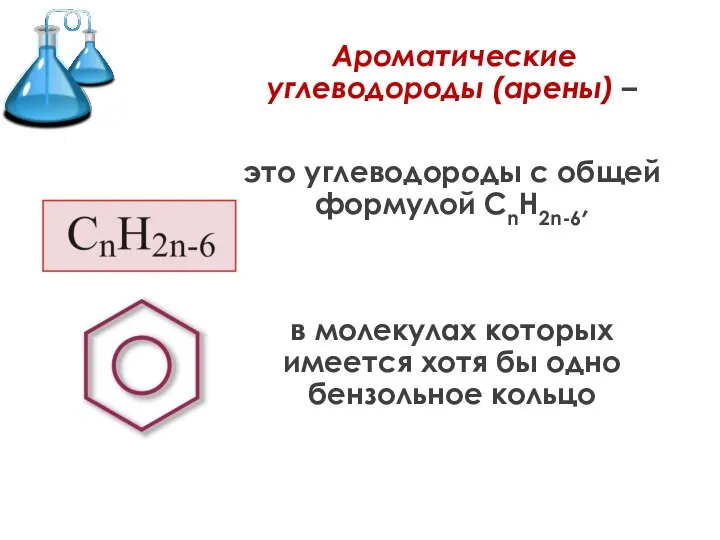
которых имеется хотя бы одно бензольное кольцо
Слайд 4Образование σ-связей в молекуле бензола
Атомы углерода в молекуле бензола находятся в состоянии
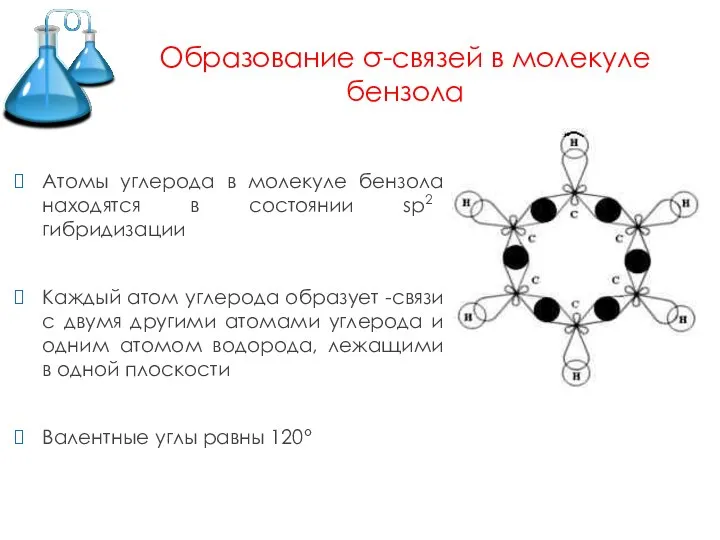
sp2 гибридизации
Каждый атом углерода образует -связи с двумя другими атомами углерода и одним атомом водорода, лежащими в одной плоскости
Валентные углы равны 120°
Слайд 5Образование π-системы в молекуле бензола
Каждый атом углерода имеет одну негибридную р-орбиталь
Шесть
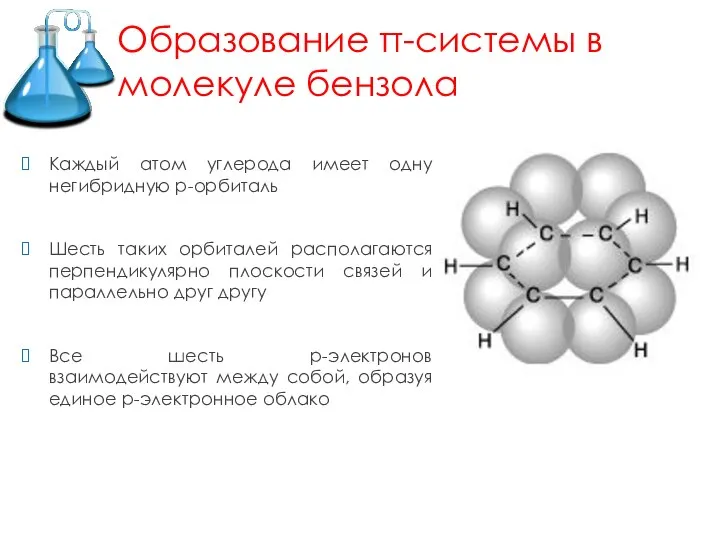
таких орбиталей располагаются перпендикулярно плоскости связей и параллельно друг другу
Все шесть р-электронов взаимодействуют между собой, образуя единое р-электронное облако
Слайд 6Таким образом, в молекуле бензола осуществляется круговое сопряжение. Наибольшая р-электронная плотность в
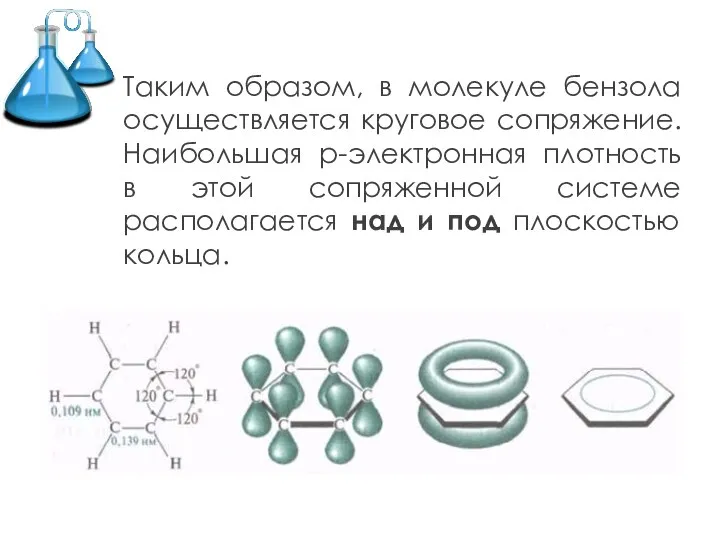
этой сопряженной системе располагается над и под плоскостью кольца.
Слайд 11Физические свойства
Бензол
Бесцветная, летучая, огнеопасная жидкость
С неприятным запахом
Легче воды ( р=0,88 г/см3)
Не смешивается

с водой
Растворим в органических растворителях
Сам является растворителем.
Бензол кипит при 80,1 С
При охлаждении легко застывает в белую кристаллическую массу
Бензол и его пары ядовиты
Систематическое вдыхание его паров вызывает анемию и лейкемию.
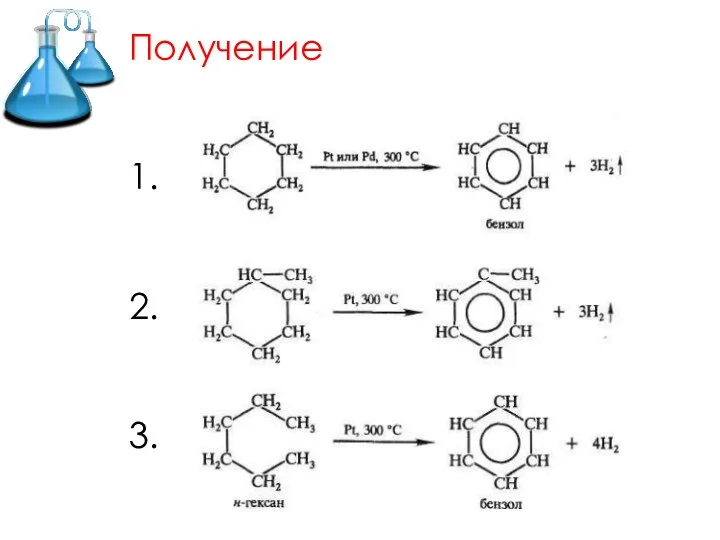
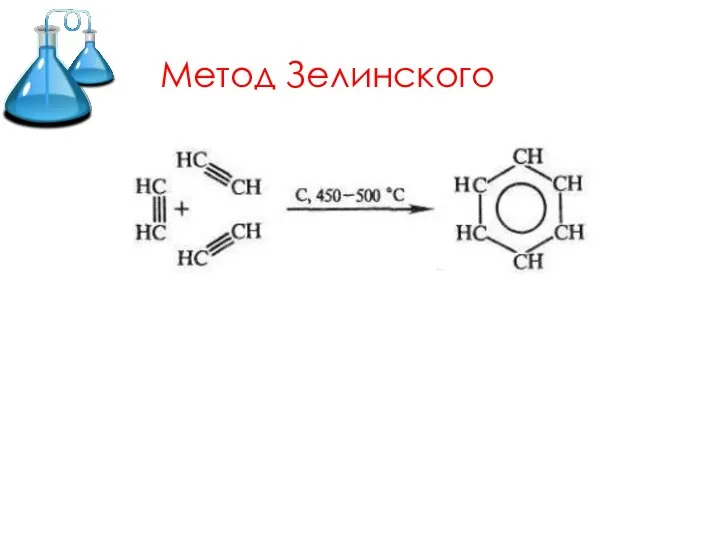
Слайд 14Химические свойства
1. Реакции окисления
1) Горение
2) НЕ обесцвечивает раствор перманганата калия и бромную
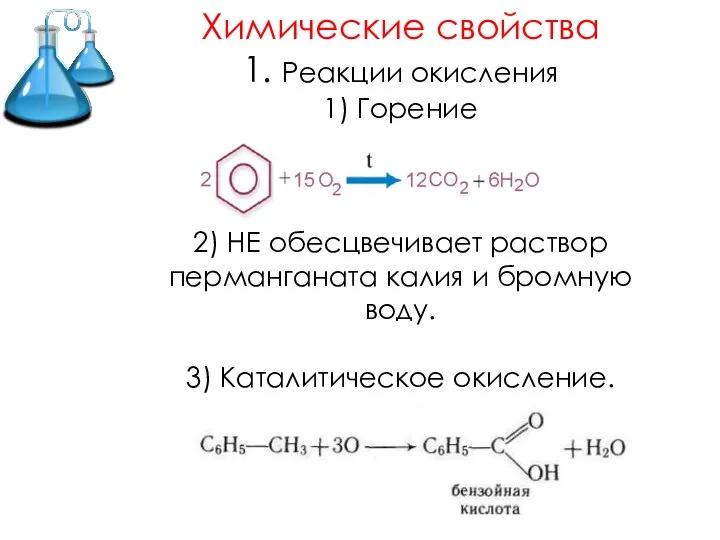
воду.
3) Каталитическое окисление.
Слайд 152. Реакции замещения
1) Галогенирование
2) Нитрование
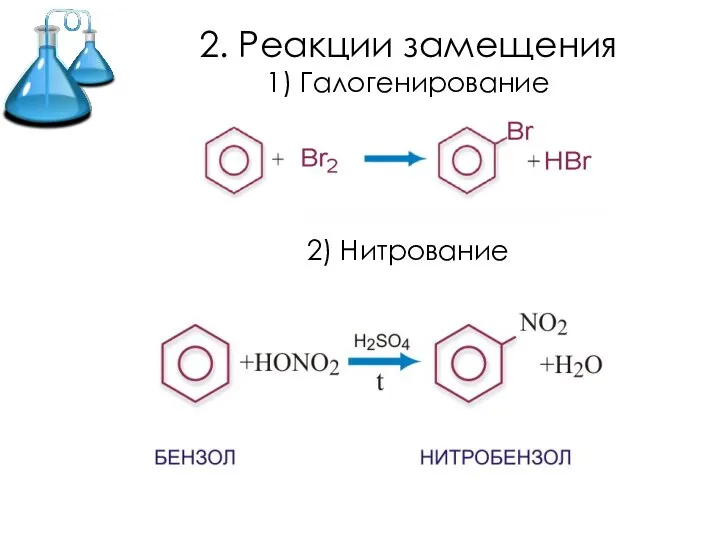
Слайд 162. Реакции присоединения
1) Хлорирование
2) Гидрирование
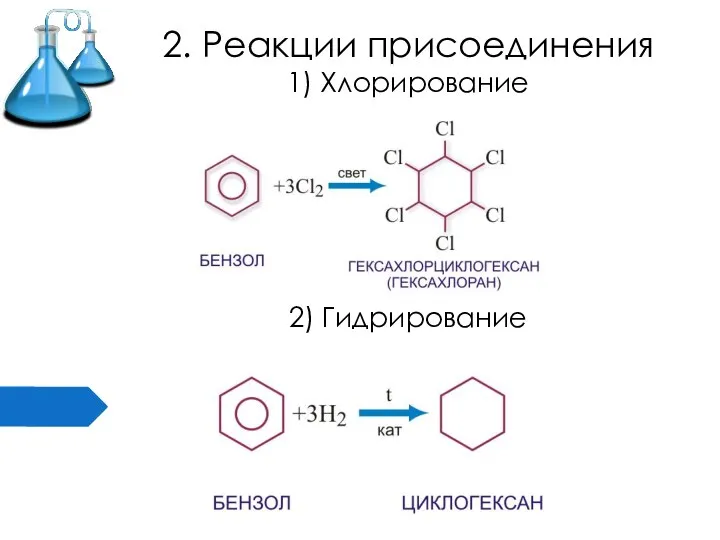
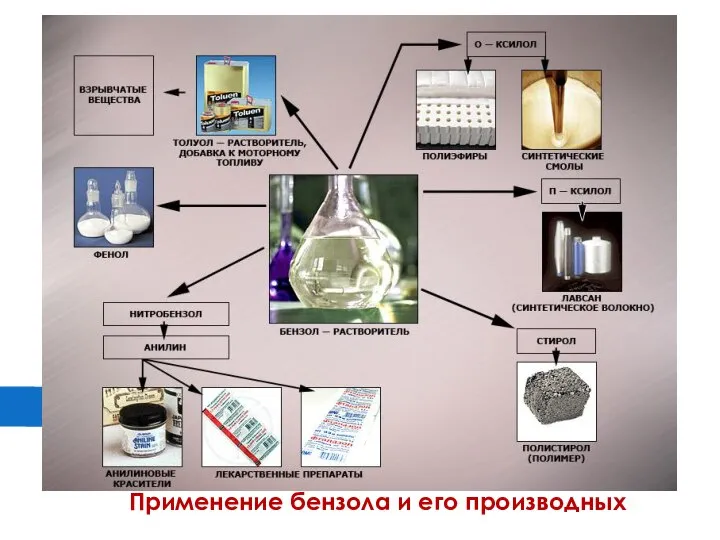
Слайд 17Применение бензола и его производных









 Ионные уравнения. Практическая работа
Ионные уравнения. Практическая работа Виды оксидов азота
Виды оксидов азота Классы неорганических веществ. Оксиды
Классы неорганических веществ. Оксиды Гидролиз солей
Гидролиз солей Металлическая ионная ковалентная связи
Металлическая ионная ковалентная связи Амины. Аминокислоты
Амины. Аминокислоты Анализ образцов колбасных изделий, образцов бытовой химии, напитков
Анализ образцов колбасных изделий, образцов бытовой химии, напитков Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Обмен нуклеопротеинов в организме
Обмен нуклеопротеинов в организме Контрольная работа №1
Контрольная работа №1 Расчеты по химическим уравнениям реакций
Расчеты по химическим уравнениям реакций Коагуляция в дисперсных системах
Коагуляция в дисперсных системах Получение этилового спирта из древесины
Получение этилового спирта из древесины Химические реакции
Химические реакции Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Строение вещества
Строение вещества Анилин. Строение и свойства анилина
Анилин. Строение и свойства анилина Получение галогеноалканов
Получение галогеноалканов Химия окислительновосстановительные реакции
Химия окислительновосстановительные реакции Способы выражения концентраций растворов
Способы выражения концентраций растворов Схема монооксигеназной цепи микросом
Схема монооксигеназной цепи микросом Карбоновые кислоты
Карбоновые кислоты Азот
Азот Химия элементов VIA группы
Химия элементов VIA группы Алкены. Строение, номенклатура, изомерия
Алкены. Строение, номенклатура, изомерия Электролитическая диссоциация. 8 класс
Электролитическая диссоциация. 8 класс Введение в биохимию
Введение в биохимию Вольтамперометрия. Полярография постоянного тока. Лекция 3 (ФХМА)
Вольтамперометрия. Полярография постоянного тока. Лекция 3 (ФХМА)