Слайд 2 Химические реакции – процессы в результате которого из одних веществ получаются

другие, отличающиеся по составу и строению.
Слайд 3 І.По числу и составу реагирующих веществ
1.1 Реакции идущие с изменением

состава веществ.
1. Реакции соединения 2Н2 + О2 = 2Н2О
2. Реакции разложения 2Н2О = 2Н2 + О2
NaNO3 = NaNO2 + O2
3. Реакция замещения Fe + HCl = FeCl2 + H2
4. Реакция обмена LiOH + HCl = LiCl + H2O
1.2. Реакции идущие без изменения состава веществ.
С ( графит) = С ( алмаз)
S ( ромбическая) = s ( моноклинная)
Р ( белый) = Р (красный)
Sn (белое олово) = Sn (серое олово)
3О2 ( кислород) = 2О3 (озон)
Слайд 4 ІІ По изменению степеней окисления химических элементов, образующих вещества.
2.1Реакции идущие с

изменением степеней окисления элементов
окислительно – восстановительные реакции(к ним относятся реакции замещения, соединения, разложения).
MnO2 +4HCl= MnCl2 + Cl2 + H2O
2.2 Реакции идущие без изменения степени окисления
K2O + H2O = 2KOH
Слайд 5III По тепловому эффекту.
3.1. Экзотермические .
S + O2 = SO2 +

Q
3.2. Эндотермические.
N2 + O2 = 2NO - Q
Слайд 6IV По агрегатному состоянию реагирующих веществ.
4.1 Гетерогенные.
Zn(ТВ) + СuSO4(Р-Р) = Cu(ТВ)

+ ZnSO4(Р-Р)
4.2 Гомогенные.
H2(Г) + Cl2(Г) = 2HCl(Г)
Слайд 7V. По участию катализатора.
5.1. Некаталитические.
4Al + 3O2 =2Al2O3
5.2. Каталитические.
2H2O2 MnO2

Слайд 8VI. По направлению.
6.1. Необратимые:
а) выделяется газ: 2HgO t 2Hg + O2
б)выделяется

осадок: BaCl2 + H2SO4 BaSO4 + HCl
в)выделяется вода: 2NaOH + 2HCl H2O + 2NaCl
6.2. Обратимые:
N2 + 3H2 2NH3







 Введение в общую теорию поверхностных явлений. Лекция 1
Введение в общую теорию поверхностных явлений. Лекция 1 Растворение. Растворы. Свойства растворов электролитов, ионные уравнения, ОВР
Растворение. Растворы. Свойства растворов электролитов, ионные уравнения, ОВР Презентация на тему Ковалентная неполярная связь
Презентация на тему Ковалентная неполярная связь  Хлороводород и соляная кислота
Хлороводород и соляная кислота Современная аналитическая химия.Учебная литература
Современная аналитическая химия.Учебная литература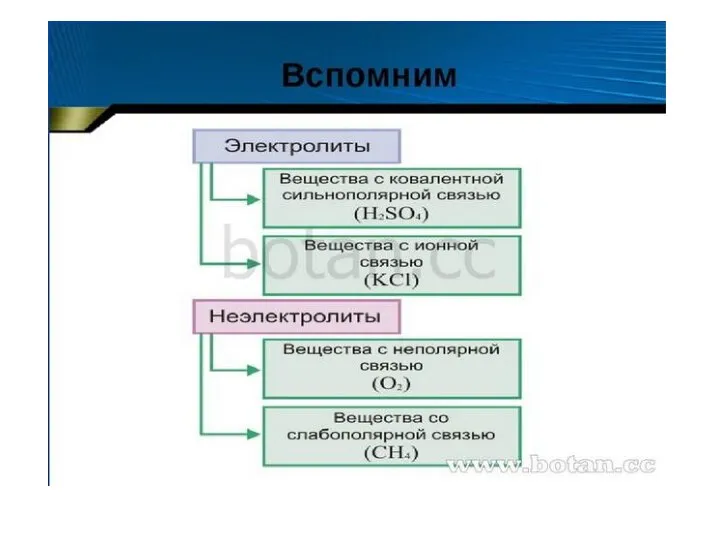 Диссоциация кислот, щелочей солей
Диссоциация кислот, щелочей солей Алкины
Алкины Автоматизация процесса сушки миксера печи СКН
Автоматизация процесса сушки миксера печи СКН Обобщение знаний по курсу органической химии
Обобщение знаний по курсу органической химии Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Виведення плям органічного походження
Виведення плям органічного походження Презентация на тему Полезная химия во фруктах и овощах
Презентация на тему Полезная химия во фруктах и овощах  Металлы. Атомы металлов
Металлы. Атомы металлов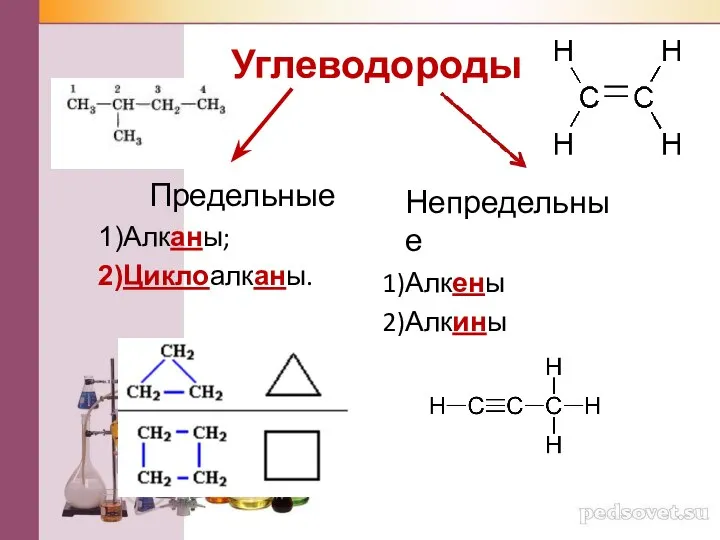 Углеводороды
Углеводороды Основания. Формулы двух амфотерных оксидов
Основания. Формулы двух амфотерных оксидов Все о пище с точки зрения химии
Все о пище с точки зрения химии Алканы – строение, химические свойства
Алканы – строение, химические свойства Презентация на тему Шарики счастья
Презентация на тему Шарики счастья  Основные законы и понятия химии. Основные классы неорганических соединений. Химический эквивалент. Закон эквивалентов
Основные законы и понятия химии. Основные классы неорганических соединений. Химический эквивалент. Закон эквивалентов Чистые вещества и смеси
Чистые вещества и смеси Донорно-акцепторный механизм образование связи
Донорно-акцепторный механизм образование связи Кристаллы и аморфные тела
Кристаллы и аморфные тела Комбинированные удобрения. Нитрофоски
Комбинированные удобрения. Нитрофоски Юные химики. Своя игра
Юные химики. Своя игра Типы химической связи
Типы химической связи Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Химия в системе современных естественнонаучных представлений
Химия в системе современных естественнонаучных представлений ATOMPP
ATOMPP