Содержание
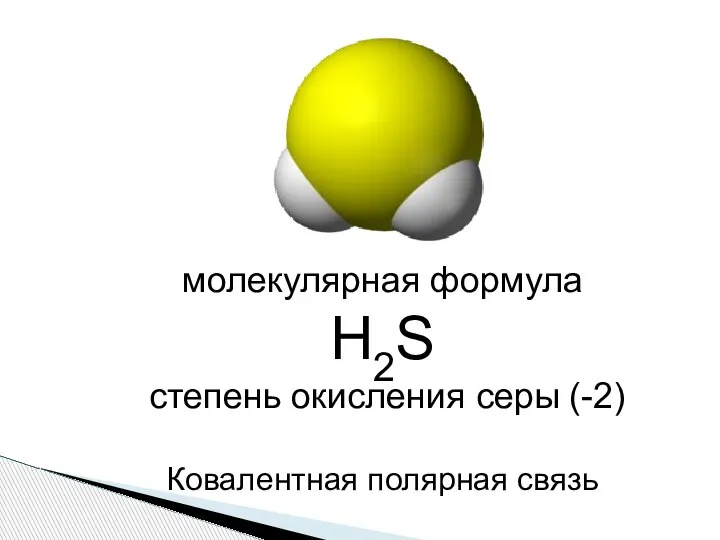
- 2. молекулярная формула Н2S степень окисления серы (-2) Ковалентная полярная связь
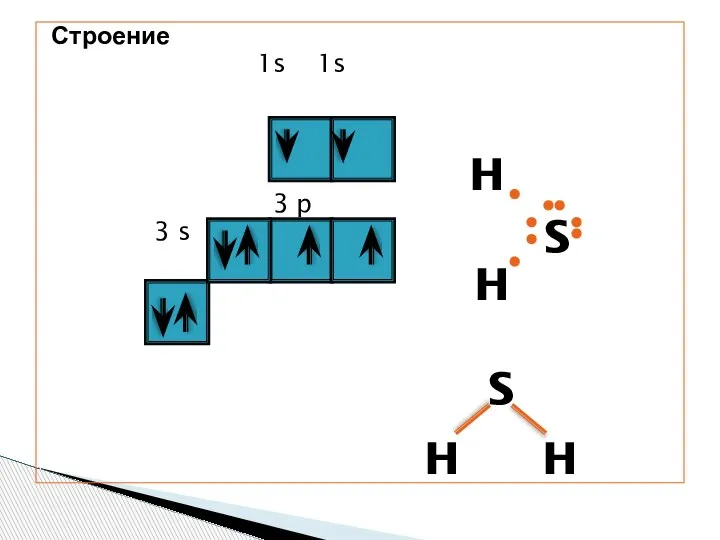
- 3. Строение 1s 1s 3 p 3 s H H S S H H
- 4. Молекула сероводорода имеет угловую форму, поэтому она полярна. В отличие от молекул воды, атомы водорода в
- 5. Нахождение в природе в свободном состоянии встречается в составе вулканических газов, во многих источниках вулканических местностей,
- 6. в растворенном и отчасти в свободном состоянии сероводород содержится в Черном море, начиная с глубины 200
- 7. в небольших количествах он образуется всюду, где происходит разложение или гниение органических веществ: она присутствует в
- 8. Д воздух -? М(Воздух)= 29 г/моль М(H2S)= 34 г/моль Д воздух = 34:29=1,17 Д воздух =1,17
- 9. Сероводоро́д (серни́стый водоро́д, сульфи́д водоро́да) 1. Бесцветный газ с запахом тухлых яиц и сладковатым вкусом. 2.
- 10. 1. В лаборатории сероводород получают взаимодействием сульфида железа с соляной или разбавленной серной кислотами: FeS +
- 11. 1 ступень H2S → H+ + HS- 2 ступень HS- ↔ H+ + S2- Диссоциация по
- 12. Взаимодействуют: - меняют окраску индикаторов -с основаниями -основными и амфотерными оксидами металлами солями Общие свойства кислот
- 13. H2S + NaOH → NaHS + H2O избыток H2S + 2NaOH → Na2S + 2H2O избыток
- 14. Сероводород горит на воздухе голубым пламенем при этом образуется сернистый газ или оксид серы(IV) 2H2S-2 +
- 15. Сероводород обладает свойствами восстановителя: если в пробирку с сероводородом прилить небольшое количество йодной воды, то раствор
- 16. Влияние сероводорода на окружающую среду и здоровье человека Очень токсичен. Вдыхание воздуха с содержанием сероводорода вызывает
- 17. Сероводород из-за своей токсичности находит ограниченное применение. В аналитической химии сероводород и сероводородная вода используются как
- 18. Сероводород применяют д для получения серной кислоты, элементной серы, сульфидов. В медицине — в составе природных
- 19. Сульфиды калия, стронция и бария используются в кожевенном деле для удаления шерсти со шкур перед их
- 22. Скачать презентацию

















 К 180-летию со дня рождения Д.И. Менделеева
К 180-летию со дня рождения Д.И. Менделеева Дисперсные системы
Дисперсные системы Химия и география. Викторина
Химия и география. Викторина Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем
Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем Бутилацетат. Химическая формула бутилацетата
Бутилацетат. Химическая формула бутилацетата строение атома
строение атома Органическая химия
Органическая химия История создания периодической таблицы
История создания периодической таблицы Исследования в химической лаборатории УГПИ
Исследования в химической лаборатории УГПИ Комплексонометрия. Способы комплексонометрического титрования
Комплексонометрия. Способы комплексонометрического титрования Нефть: состав, свойства и переработка
Нефть: состав, свойства и переработка Мицеллобразование (2)
Мицеллобразование (2) Произведение растворимости
Произведение растворимости Электролит
Электролит Кислоты. Свойства кислот
Кислоты. Свойства кислот Как вырастить кристалл
Как вырастить кристалл Тотығу - тотықсыздану реакциясы
Тотығу - тотықсыздану реакциясы Презентация на тему Щелочные металлы (9 класс)
Презентация на тему Щелочные металлы (9 класс)  Кислоты органические и неорганически
Кислоты органические и неорганически Химическая термодинамика
Химическая термодинамика Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ
Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ Галогены элементы VII – А группы
Галогены элементы VII – А группы Соли, их классификация и свойства
Соли, их классификация и свойства Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс
Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс Расчет физических свойств нефтепродуктов. Практическая работа 1
Расчет физических свойств нефтепродуктов. Практическая работа 1 Подготовка к ГИА 2021
Подготовка к ГИА 2021 Презентация на тему Карбонаты
Презентация на тему Карбонаты  Химия и производство
Химия и производство