Содержание
- 2. ЦЕЛИ ЛЕКЦИИ ОБУЧАЮЩАЯ: сформировать знания об основах химической термодинамики, первом законе термодинамики и законе Гесса. РАЗВИВАЮЩАЯ:
- 3. Термодинамика - это наука, изучающая взаимные превращения различных видов энергии, связанные с переходом энергии в форме
- 4. Основные понятия и термины Термодинамическая система (ТД система) - это любой объект природы, состоящий из достаточно
- 5. Основные понятия химической термодинамики Часть объектов природы, не входящих в систему, называется средой. Важными характеристиками системы
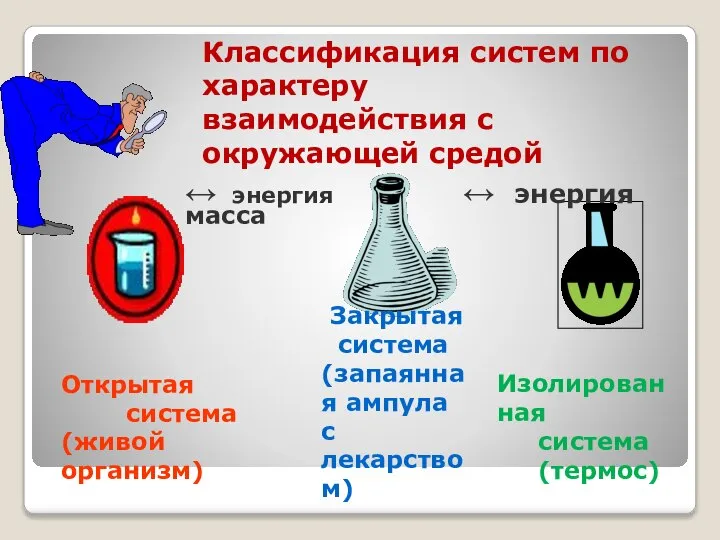
- 6. Если система обменивается с окружающей средой энергией и массой, то она называется открытой. Когда система обменивается
- 7. Открытая система (живой организм) Закрытая система (запаянная ампула с лекарством) Изолированная система (термос) Классификация систем по
- 8. Основные понятия химической термодинамики Фаза - это часть системы с одинаковыми физическими и химическими свойствами, отделенная
- 9. Основные понятия химической термодинамики В зависимости от фазового состояния различают: 1. Гомогенные системы. Это системы, в
- 10. Основные понятия химической термодинамики
- 11. Основные понятия химической термодинамики Термодинамические параметры называются стандартными, если они определяются при стандартных условиях. К стандартным
- 12. Основные понятия химической термодинамики В зависимости от того, какой из параметров состояния при протекании термодинамического процесса
- 13. Функции состояния системы В термодинамике для определения изменения энергии системы пользуются различными энергетическими характеристиками, которые называются
- 14. К термодинамическим функциям системы относятся: 1. Внутренняя энергия (U). 2. Энтальпия (Н). 3. Энтропия (S). 4.
- 15. 1. Внутренняя энергия (U) Внутренняя энергия системы складывается из кинетической энергии движения молекул или атомов, образующих
- 16. Внутренняя энергия (U): Абсолютное значение внутренней энергии измерить невозможно, поэтому измеряют ее приращение: ΔUсистемы = Uкон
- 17. ΔU=Q V , где Q V - теплота изохорного процесса. ΔU - кДж/моль или кДж· моль-1
- 18. Единицы измерения энергии: Джоуль = Дж Так как Дж очень маленькая величина, обычно используют кДж. калория
- 19. Первый закон термодинамики Первый закон термодинамики является постулатом: он не может быть доказан логическим путем, а
- 20. Теплота и работа: приращение внутренней работы ± Q = ΔU ± W Работа, совершаемая системой (+)
- 21. Теплота (Q) - форма передачи энергии, посредством хаотического столкновения частиц соприкасающихся систем, системы и среды. Q
- 22. Первый закон термодинамики Работа (W) - форма передачи энергии от системы в окружающую среду или другой
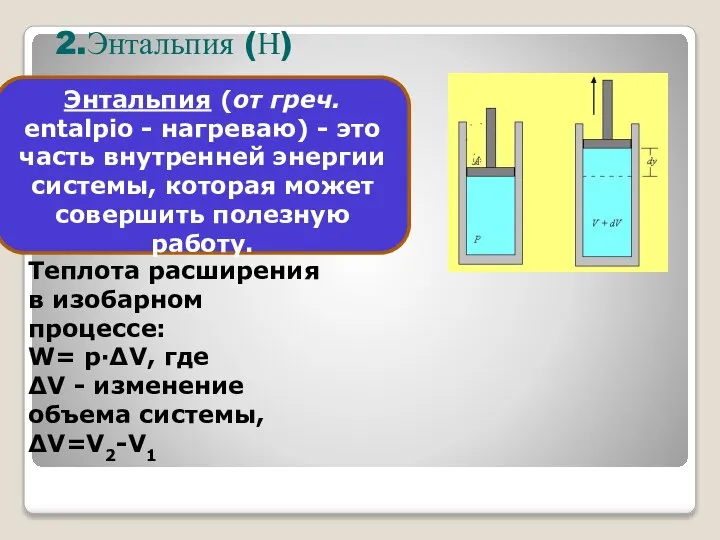
- 23. Теплота расширения в изобарном процессе: W= p·ΔV, где ΔV - изменение объема системы, ΔV=V2-V1 Энтальпия (от
- 24. Энтальпия (H): Абсолютное значение энтальпии измерить невозможно, поэтому измеряют ее приращение: ΔHсистемы = Hкон - Hнач
- 25. Энтропия (S) характеризует связанную энергию. В реальных необратимых системах только часть энергии превращается в работу, другая
- 26. Функции состояния системы При протекании изобарно-изотермических процессов: 5. Свободная энергия Гиббса (G) Энергия Гиббса (G) -
- 28. Скачать презентацию























 Основные классы неорганических соединений. Лекция №3
Основные классы неорганических соединений. Лекция №3 Алмазы
Алмазы Тема урока: «Свойства тканей из химических волокон»
Тема урока: «Свойства тканей из химических волокон» Презентация на тему Сахароза
Презентация на тему Сахароза  Кальций, железо. Горение стальной ваты и железного порошка
Кальций, железо. Горение стальной ваты и железного порошка Предмет химии, простые и сложные вещества
Предмет химии, простые и сложные вещества Аллотропия кислорода. Состав воздуха
Аллотропия кислорода. Состав воздуха Строение вещества. ОВР. Окислительно-восстановительные реакции
Строение вещества. ОВР. Окислительно-восстановительные реакции Строение атома
Строение атома Примеры контекстных задач в 9 классе
Примеры контекстных задач в 9 классе Л-1-5
Л-1-5 Алюминий и его соединения
Алюминий и его соединения Стекло
Стекло Массовая доля элемента в веществе
Массовая доля элемента в веществе Увлекательный мир науки и практики
Увлекательный мир науки и практики Выбраковка результатов химического анализа
Выбраковка результатов химического анализа Самородные элементы. Сера. Лекция 7
Самородные элементы. Сера. Лекция 7 Исследование концентрированных заквасок для сметаны
Исследование концентрированных заквасок для сметаны История развития органической химии
История развития органической химии Углерод. Кремний
Углерод. Кремний Электролиты и неэлектролиты. Электролитическая диссоциация
Электролиты и неэлектролиты. Электролитическая диссоциация Презентация
Презентация Карбонильные Соединения. Альдегиды и кетоны
Карбонильные Соединения. Альдегиды и кетоны Fosforan V wapnia Ca3(PO4)2
Fosforan V wapnia Ca3(PO4)2 Газ тәрізді өнімдер бромды сутек
Газ тәрізді өнімдер бромды сутек Аммиак. Азот
Аммиак. Азот Роль радикальных процессов. Свободные формы кислорода. Пероксидное окисление липидов
Роль радикальных процессов. Свободные формы кислорода. Пероксидное окисление липидов Обмен липидов
Обмен липидов