Содержание
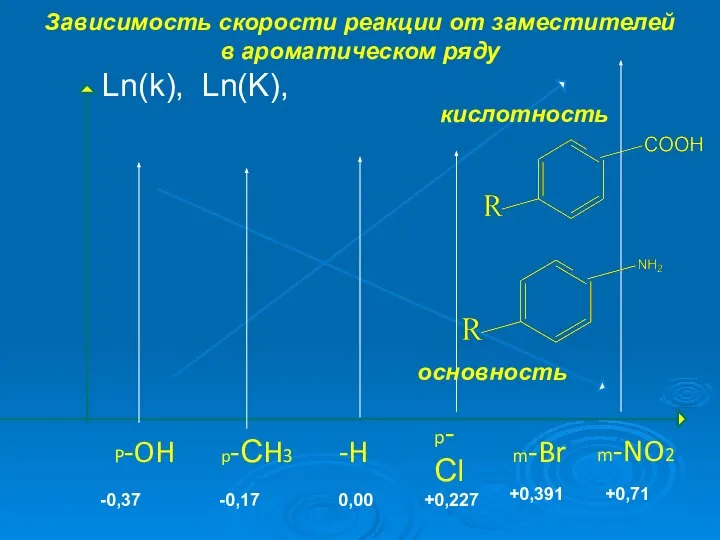
- 2. Зависимость скорости реакции от заместителей в ароматическом ряду m-NO2 p-Сl m-Br -H p-СH3 P-OH Ln(k), Ln(K),
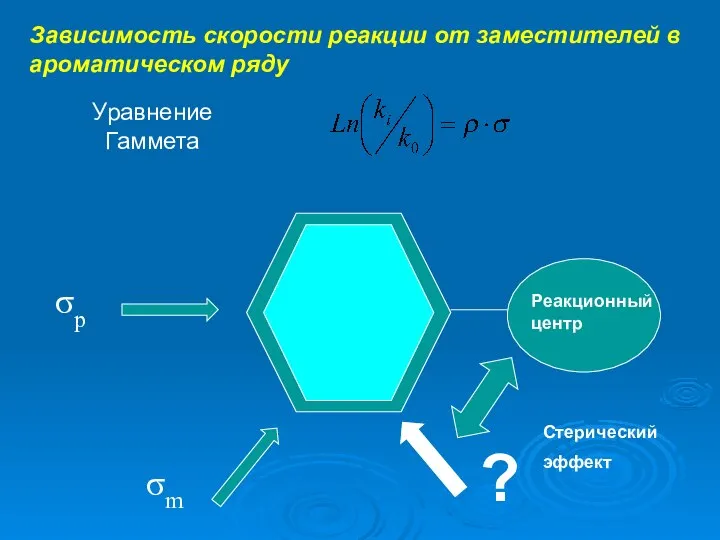
- 3. Зависимость скорости реакции от заместителей в ароматическом ряду Уравнение Гаммета σm σp Реакционный центр ? Стерический
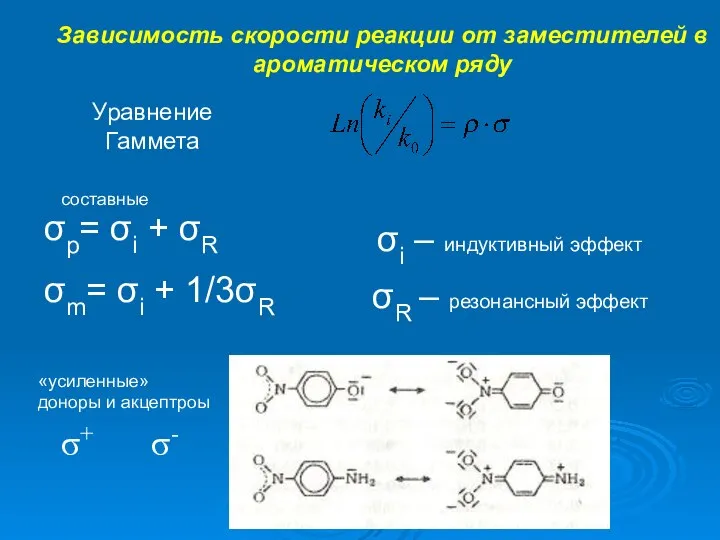
- 4. Зависимость скорости реакции от заместителей в ароматическом ряду Уравнение Гаммета σp= σi + σR σm= σi
- 5. Зависимость скорости реакции от заместителей в ароматическом ряду Уравнение Гаммета σp= σi + σR σm= σi
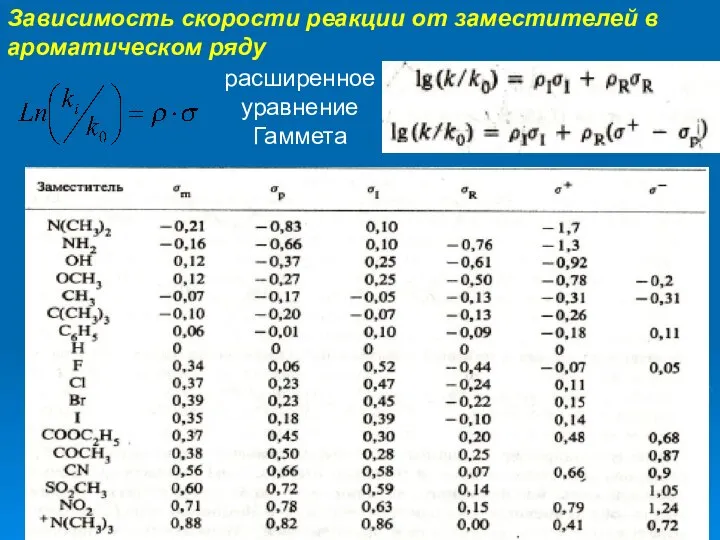
- 6. Зависимость скорости реакции от заместителей в ароматическом ряду расширенное уравнение Гаммета
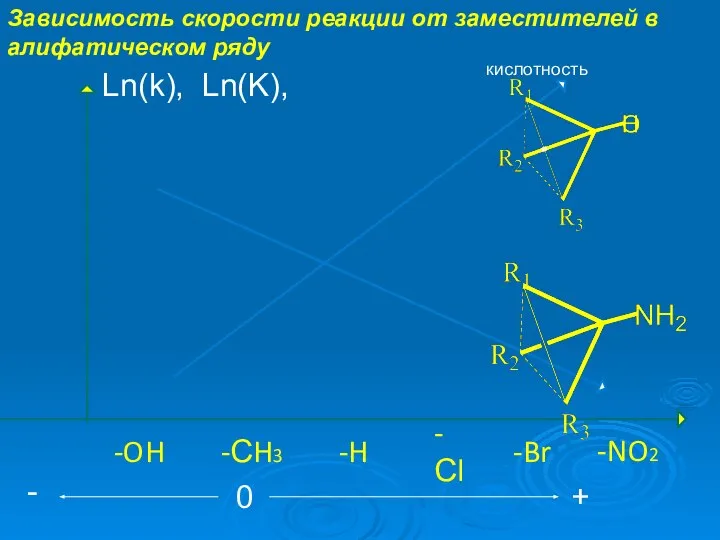
- 7. Зависимость скорости реакции от заместителей в алифатическом ряду -NO2 -Сl -Br -H -СH3 -OH Ln(k), Ln(K),
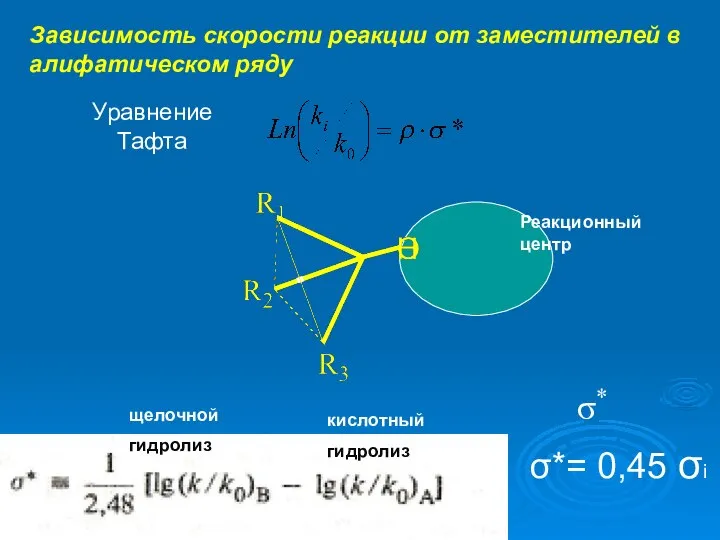
- 8. Зависимость скорости реакции от заместителей в алифатическом ряду Уравнение Тафта σ* Реакционный центр кислотный гидролиз щелочной
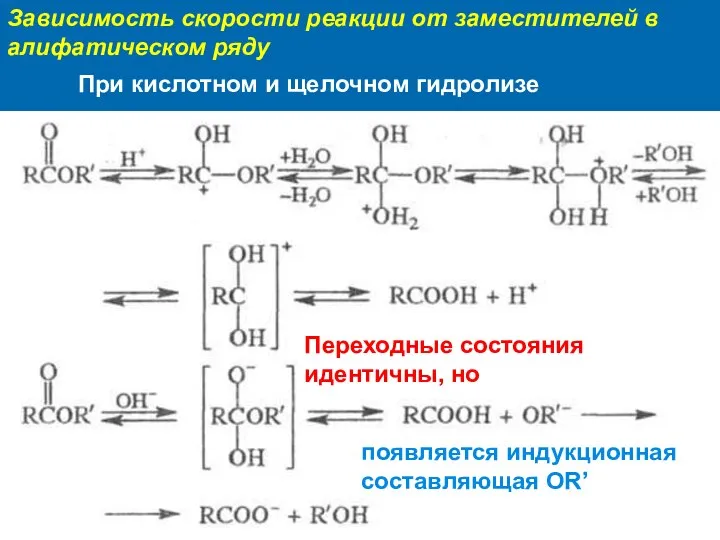
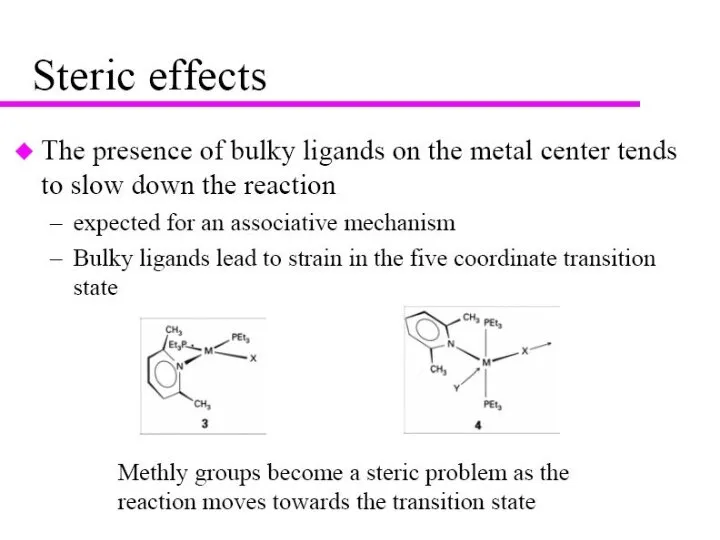
- 9. Зависимость скорости реакции от заместителей в алифатическом ряду Переходные состояния идентичны, но появляется индукционная составляющая OR’
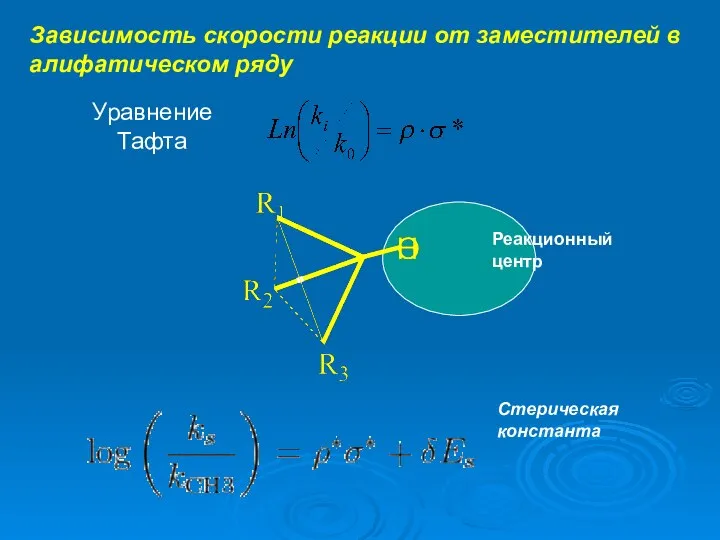
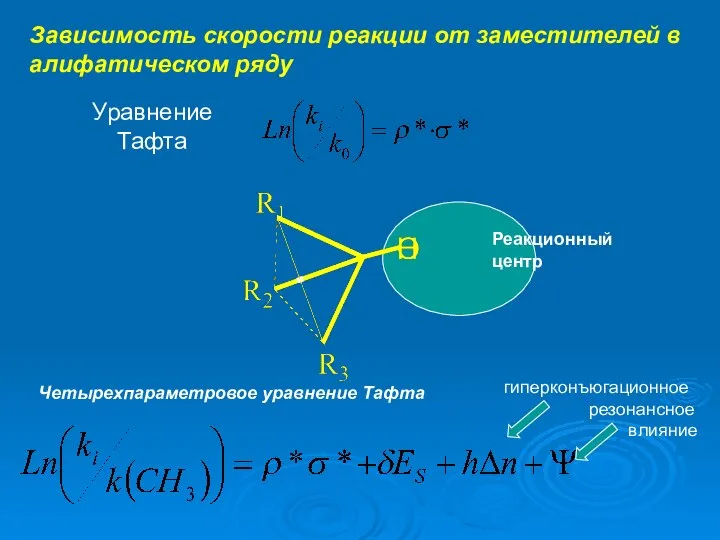
- 10. Зависимость скорости реакции от заместителей в алифатическом ряду Уравнение Тафта Реакционный центр Стерическая константа
- 12. Зависимость скорости реакции от заместителей в алифатическом ряду Уравнение Тафта Реакционный центр Четырехпараметровое уравнение Тафта гиперконъюгационное
- 13. Зависимость скорости реакции от заместителей Уравнение Гаммета Уравнение Тафта k0 = k(CH3) k0 = k(H) linear
- 14. ПРИНЦИП ЛИНЕЙНОСТИ СВОБОДНЫХ ЭНЕРГИЙ основан на линейной корреляции Ln(k) или Ln(K) одной реакции с соответствующими константами
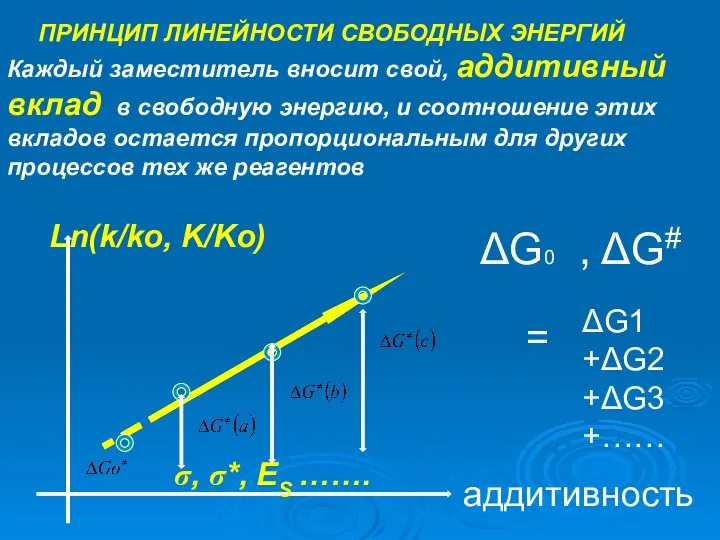
- 15. ПРИНЦИП ЛИНЕЙНОСТИ СВОБОДНЫХ ЭНЕРГИЙ Каждый заместитель вносит свой, аддитивный вклад в свободную энергию, и соотношение этих
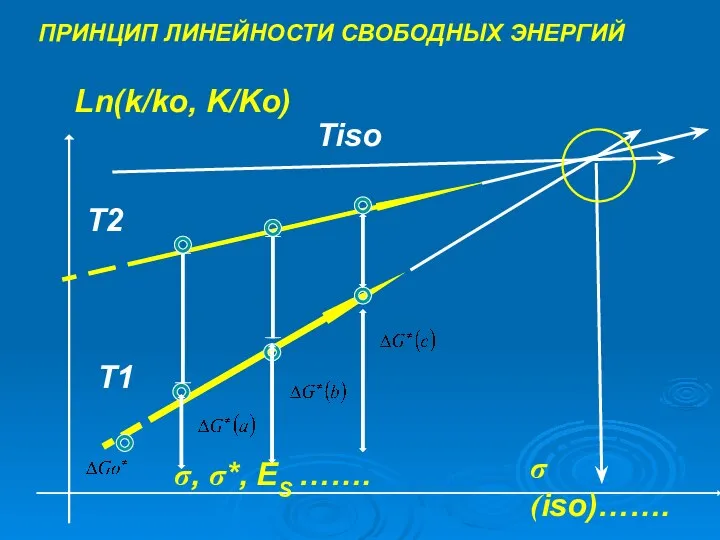
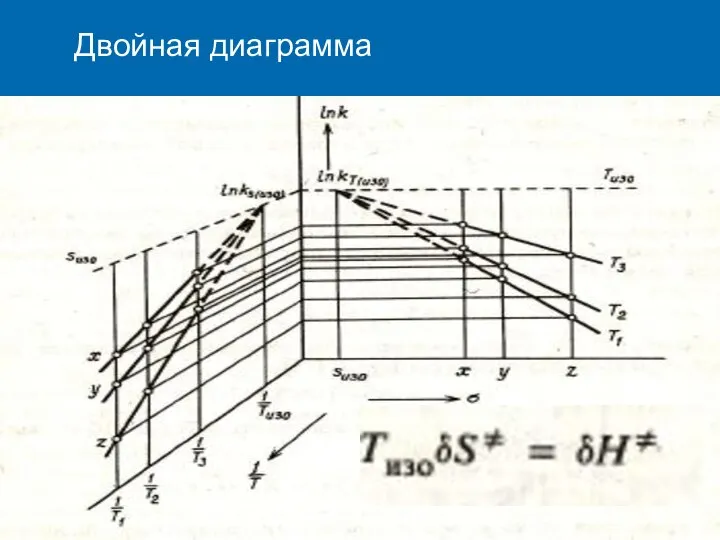
- 16. ПРИНЦИП ЛИНЕЙНОСТИ СВОБОДНЫХ ЭНЕРГИЙ Ln(k/ko, K/Ko) σ, σ*, ES ……. σ(iso)……. T2 T1 Tiso
- 17. Двойная диаграмма
- 18. Химическая связь и реакционная способность
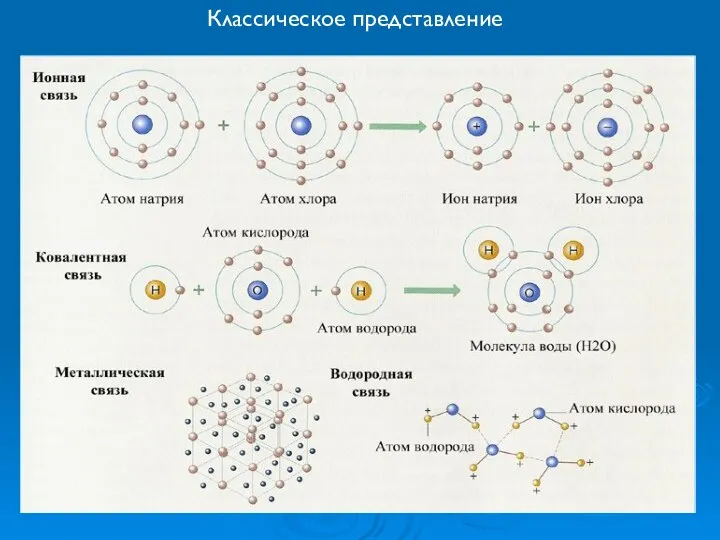
- 19. Классическое представление
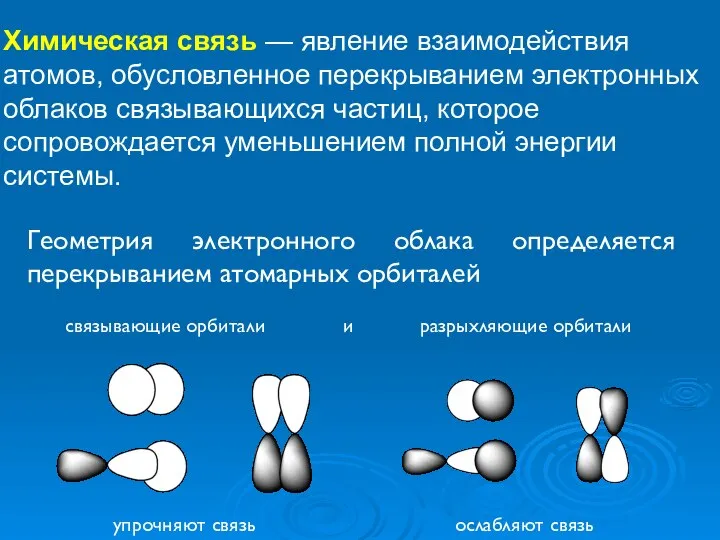
- 20. Химическая связь — явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной
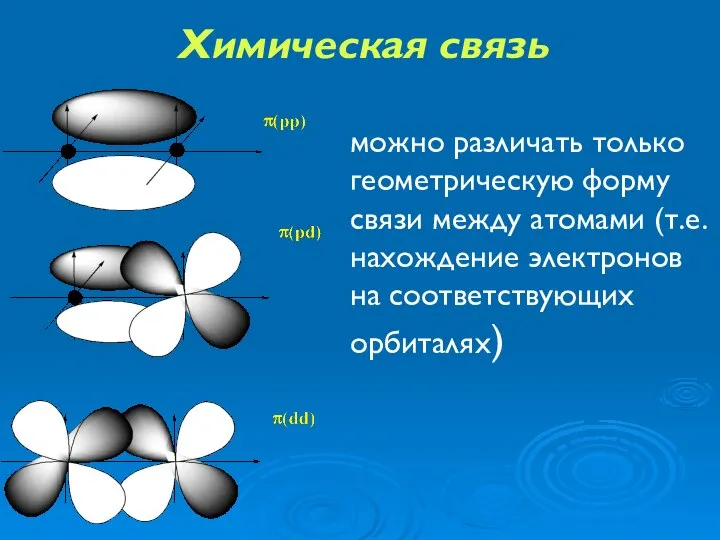
- 21. Химическая связь можно различать только геометрическую форму связи между атомами (т.е. нахождение электронов на соответствующих орбиталях)
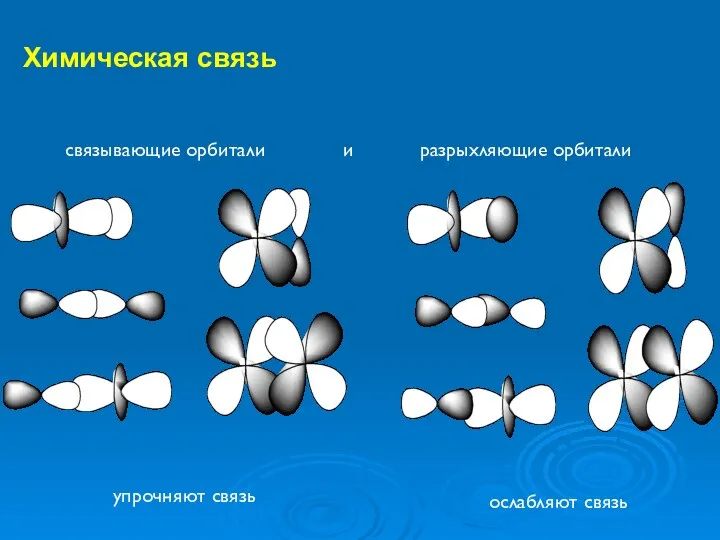
- 22. Химическая связь упрочняют связь ослабляют связь связывающие орбитали и разрыхляющие орбитали
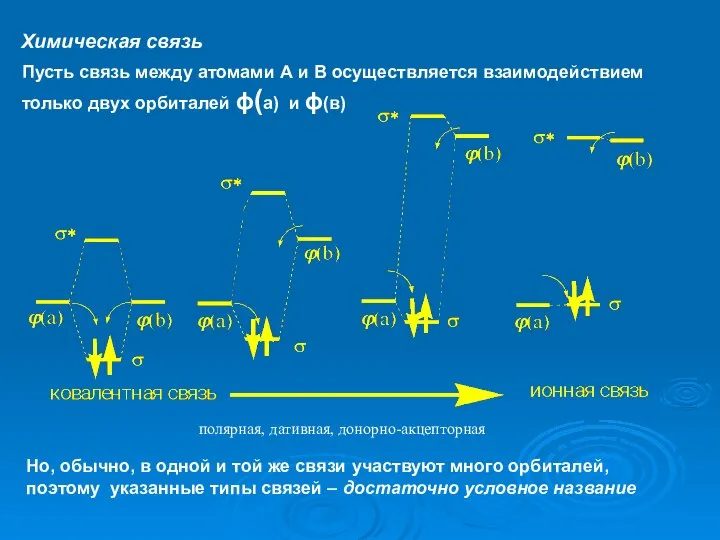
- 23. полярная, дативная, донорно-акцепторная Пусть связь между атомами А и В осуществляется взаимодействием только двух орбиталей ϕ(а)
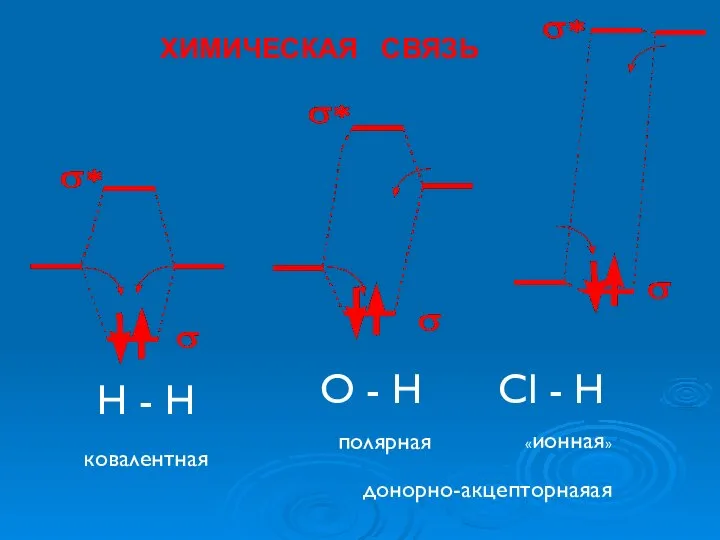
- 24. Н - Н О - Н Cl - Н ковалентная «ионная» полярная ХИМИЧЕСКАЯ СВЯЗЬ донорно-акцепторнаяая
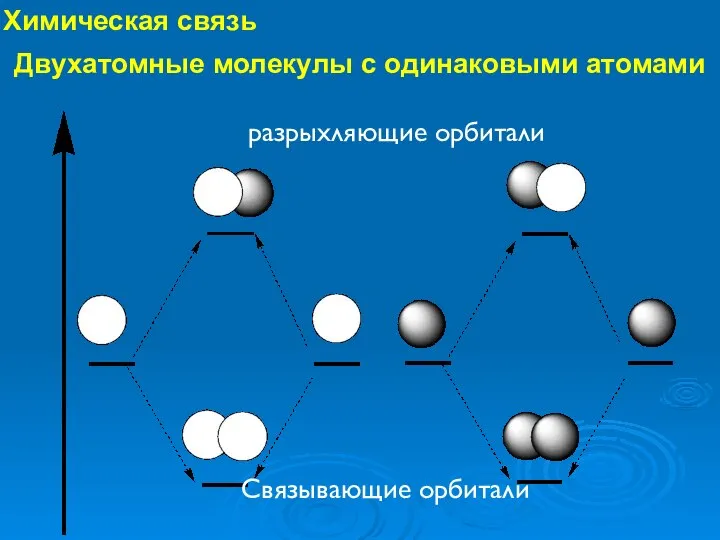
- 25. Химическая связь Связывающие орбитали разрыхляющие орбитали Двухатомные молекулы с одинаковыми атомами
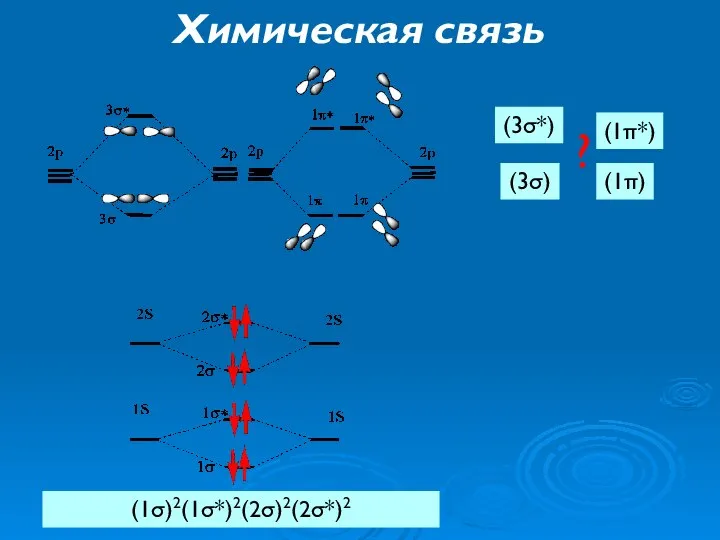
- 26. Химическая связь (1σ)2(1σ*)2(2σ)2(2σ*)2 (3σ) (3σ*) (1π) (1π*) ?
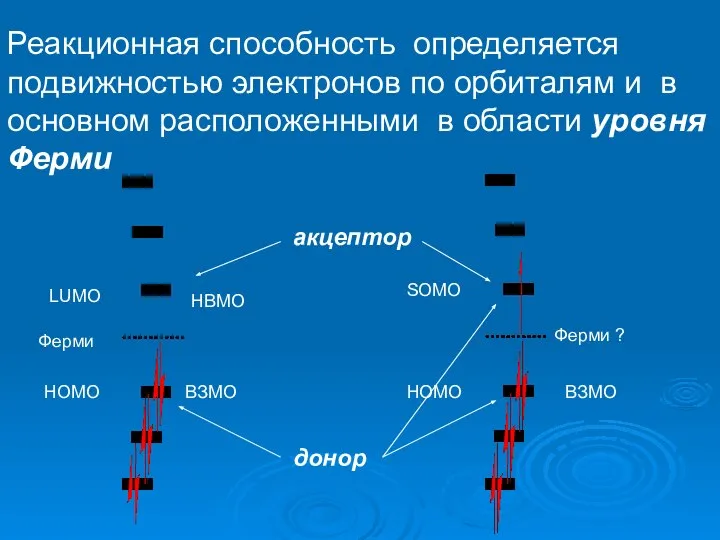
- 27. B Реакционная способность определяется подвижностью электронов по орбиталям и в основном расположенными в области уровня Ферми
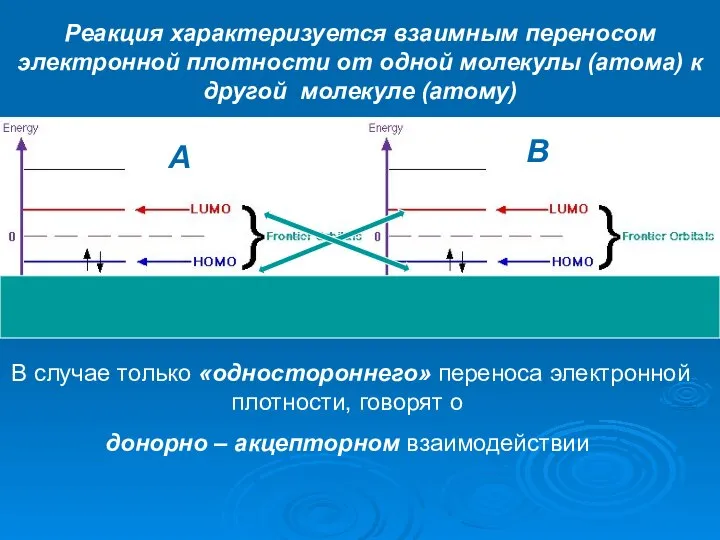
- 28. A B Реакция характеризуется взаимным переносом электронной плотности от одной молекулы (атома) к другой молекуле (атому)
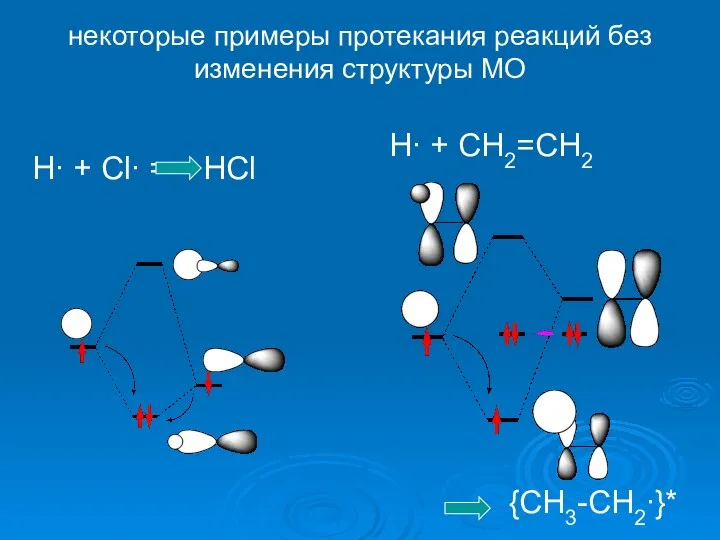
- 29. некоторые примеры протекания реакций без изменения структуры МО H∙ + Cl∙ = HCl H∙ + CH2=CH2
- 30. Типы и механизмы органических реакций Повторение – мать учения.
- 31. Механизмы реакций в органической химии По типу разрыва химической связи органические реакции подразделяют на радикальные и
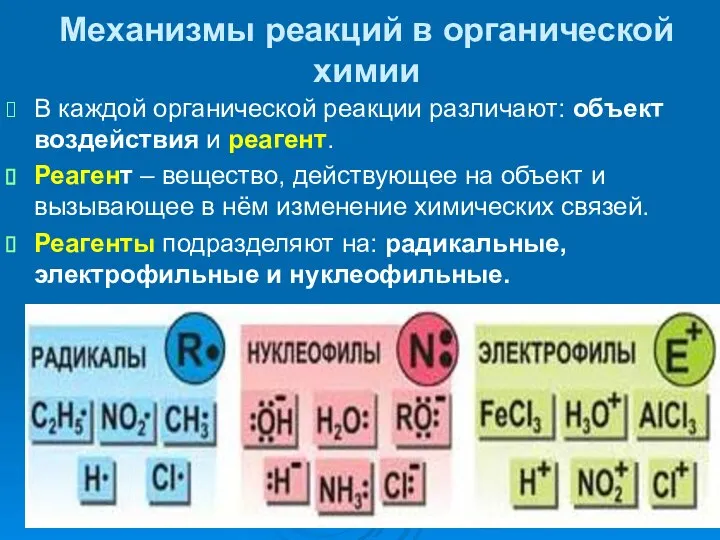
- 32. Механизмы реакций в органической химии В каждой органической реакции различают: объект воздействия и реагент. Реагент –
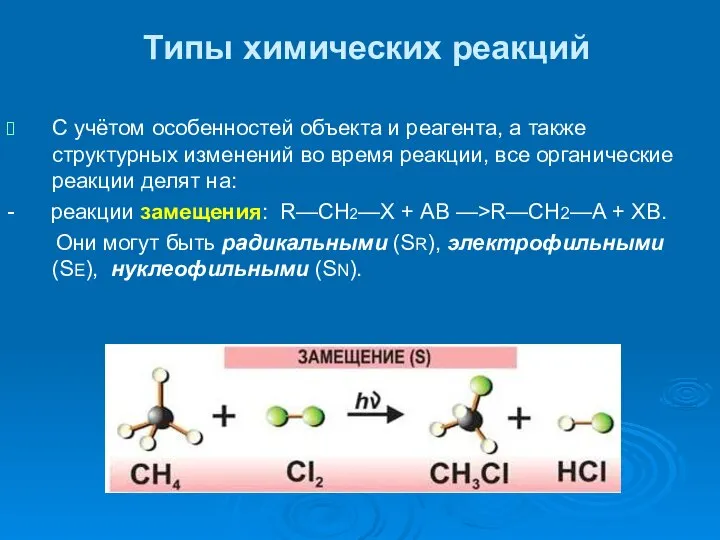
- 33. Типы химических реакций С учётом особенностей объекта и реагента, а также структурных изменений во время реакции,
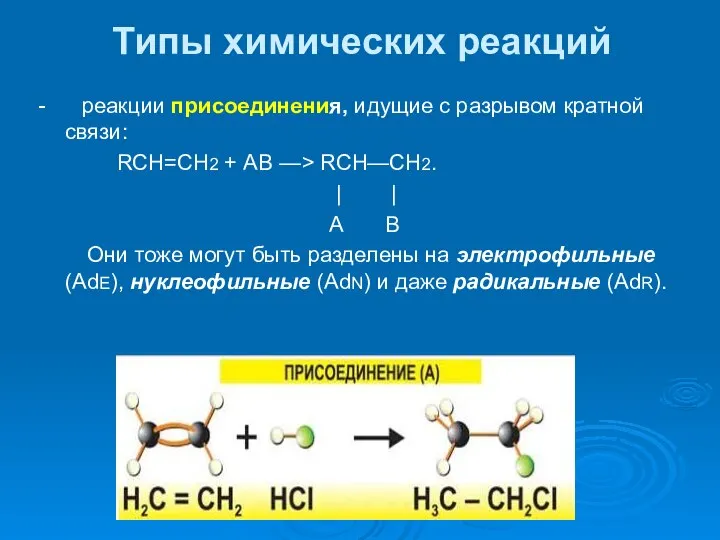
- 34. Типы химических реакций - реакции присоединения, идущие с разрывом кратной связи: RCH=CH2 + АВ —> RCH—СН2.
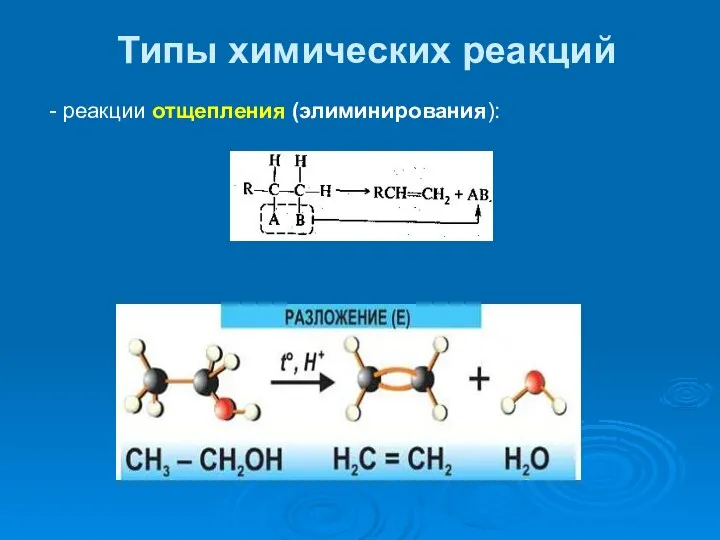
- 35. Типы химических реакций - реакции отщепления (элиминирования):
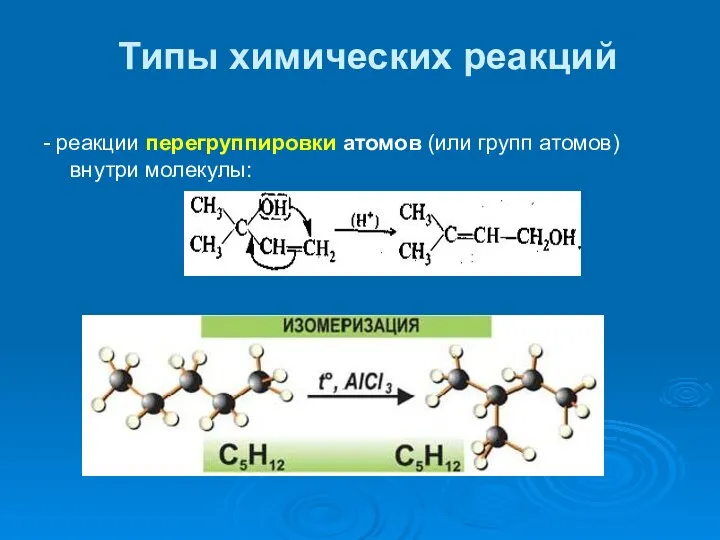
- 36. Типы химических реакций - реакции перегруппировки атомов (или групп атомов) внутри молекулы:
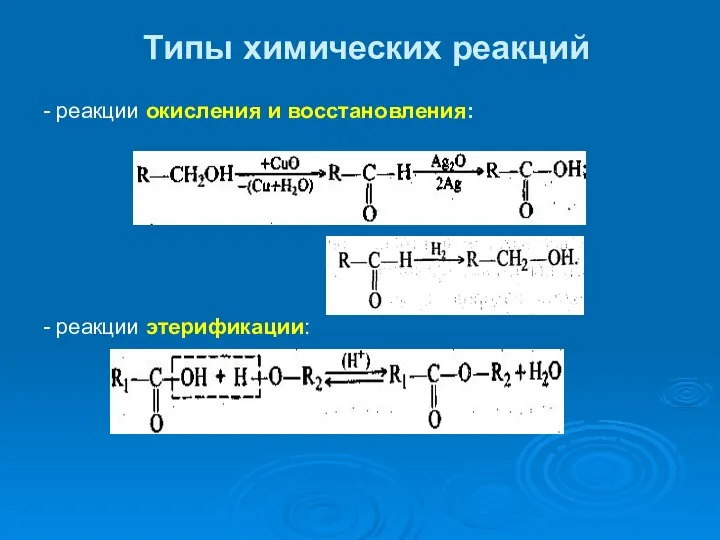
- 37. Типы химических реакций - реакции окисления и восстановления: - реакции этерификации:
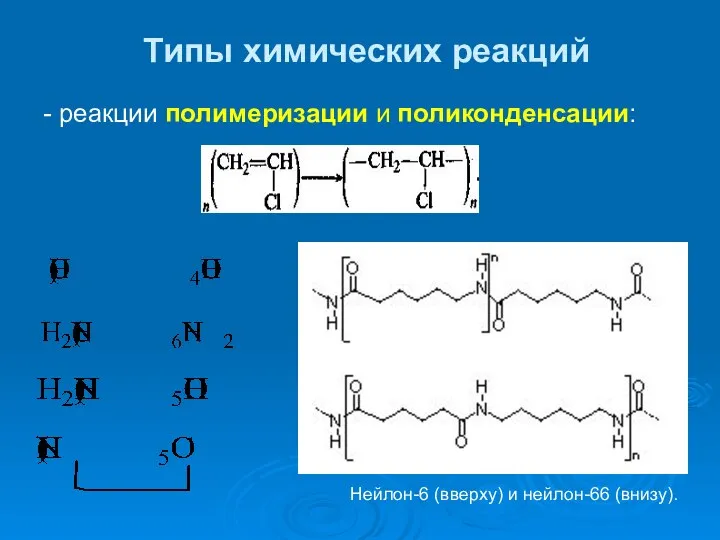
- 38. Типы химических реакций - реакции полимеризации и поликонденсации: Нейлон-6 (вверху) и нейлон-66 (внизу).
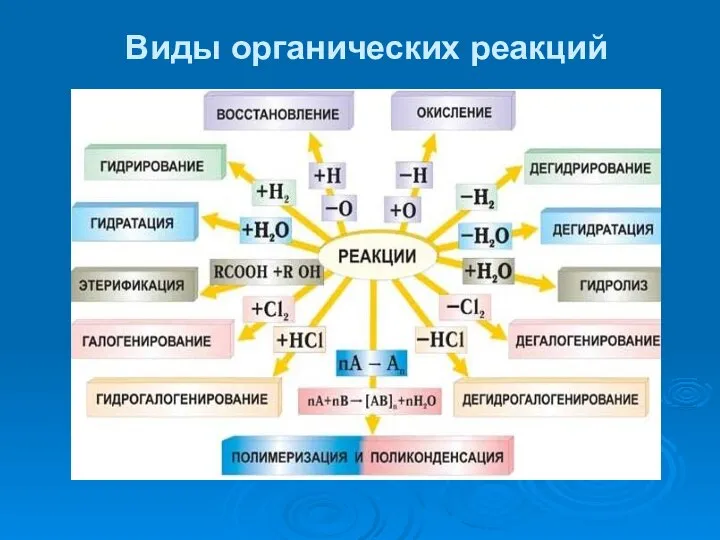
- 39. Виды органических реакций
- 41. Скачать презентацию






 Уравнение линии на плоскости
Уравнение линии на плоскости Объединение множеств
Объединение множеств Состав числа 8
Состав числа 8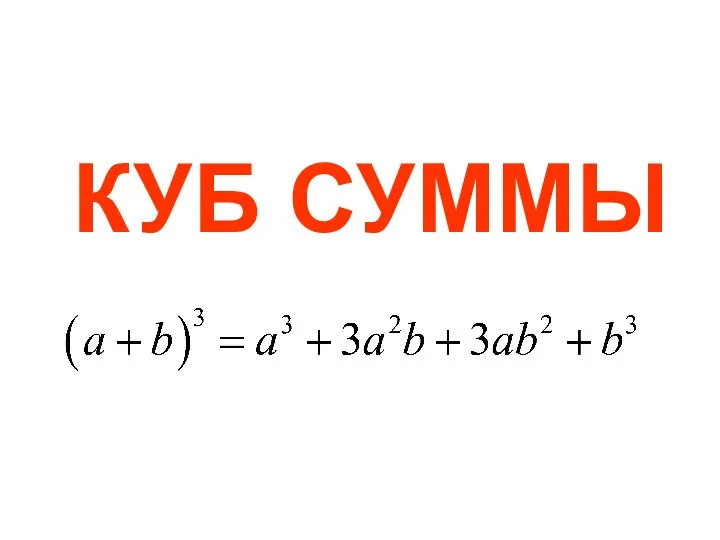 Куб суммы
Куб суммы Свойства умножения
Свойства умножения Задачи на нахождение экстремума
Задачи на нахождение экстремума Параллельные прямые. Тест
Параллельные прямые. Тест Применение мультимедийных презентаций для организации устных упражнений на уроках математики в 5-6 классах. Модуль 1
Применение мультимедийных презентаций для организации устных упражнений на уроках математики в 5-6 классах. Модуль 1 Системы уравнений
Системы уравнений Приемы вычитания с переходом на десяток
Приемы вычитания с переходом на десяток Прямоугольный треугольник
Прямоугольный треугольник Матрицы и определители
Матрицы и определители Степенные функции, их свойства и графики
Степенные функции, их свойства и графики Презентация на тему Итоговый урок: решение систем уравнений
Презентация на тему Итоговый урок: решение систем уравнений  Решение тригонометрических уравнений
Решение тригонометрических уравнений Тригонометрические уравнения сtgх=а. 10 класс
Тригонометрические уравнения сtgх=а. 10 класс Презентация на тему Дроби в Вавилоне, Египте, Риме. Открытие десятичных дробей
Презентация на тему Дроби в Вавилоне, Египте, Риме. Открытие десятичных дробей  Длина окружности. Площадь круга
Длина окружности. Площадь круга Сложение в пределах 10. Работа с математическими рассказами
Сложение в пределах 10. Работа с математическими рассказами Определенный интеграл. Формула Ньютона - Лейбница
Определенный интеграл. Формула Ньютона - Лейбница Уравнение прямой на плоскости
Уравнение прямой на плоскости Математика и Незнайка. Математическая сказка
Математика и Незнайка. Математическая сказка Математика и мир искусства
Математика и мир искусства Чирмешән муниципаль районы Лашман урта гомумбелем бирү мәктәбе
Чирмешән муниципаль районы Лашман урта гомумбелем бирү мәктәбе Развитие логико–математических представлений как основы познавательной мотивации
Развитие логико–математических представлений как основы познавательной мотивации Частное степеней
Частное степеней Доказательство равносильностей
Доказательство равносильностей Диаграммы
Диаграммы