Содержание
- 2. Важнейшие функции печени: Регуляторно-гомеостатическая – представляет процессы, которые преимущественно или исключительно происходят в печени и служат
- 3. 2. Желчеобразовательная функция – образование желчи и входящих в нее элементов: желчных кислот и желчных пигментов,
- 4. 3. Экскреторная функция – выделение в составе желчи ряда гидрофобных метаболитов, продуктов обезвреживания токсинов и лекарственных
- 5. 4. Депонирование – в печени создается запас углеводов в форме гликогена для нужд всего организма. Происходит
- 6. 5. Антитоксическая функция – представляет исключительную функцию печени, связанную с обезвреживанием всех эндогенных и экзогенных соединений,
- 7. 6. Образование желчных пигментов 6. Образование желчных пигментов
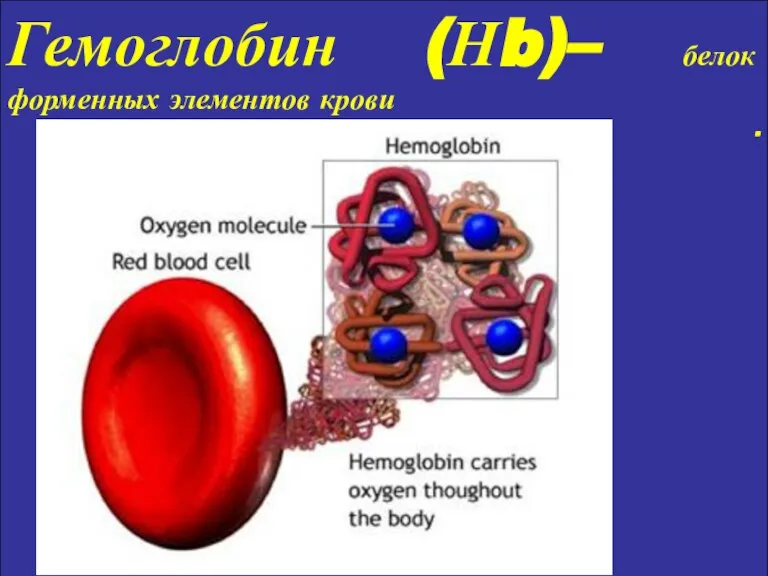
- 8. Гемоглобин (Нb)– белок форменных элементов крови .
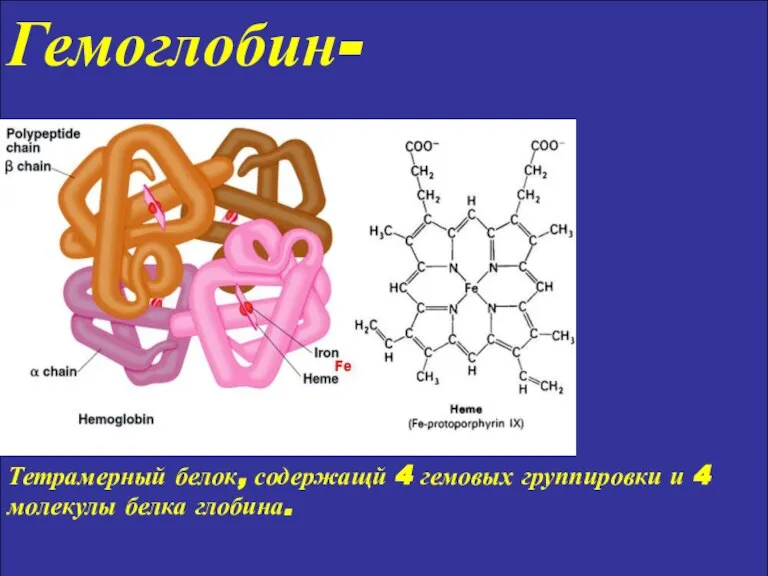
- 9. Гемоглобин- Тетрамерный белок, содержащй 4 гемовых группировки и 4 молекулы белка глобина.
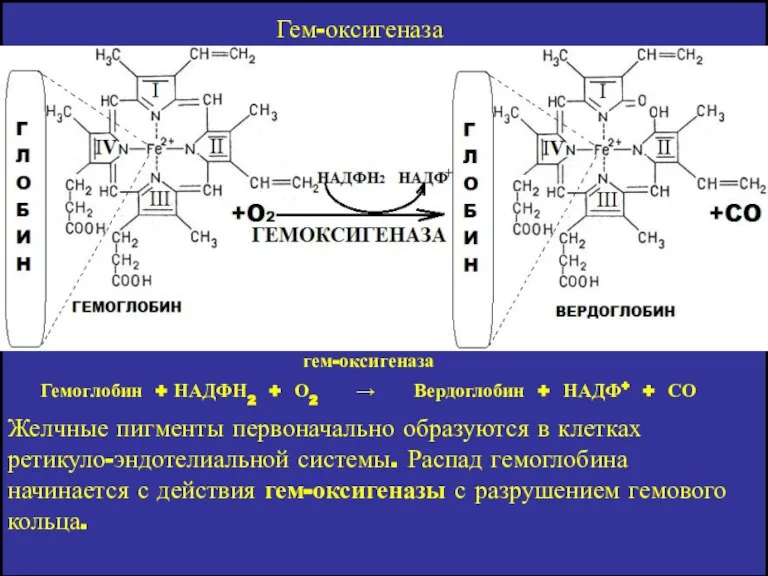
- 10. Желчные пигменты первоначально образуются в клетках ретикуло-эндотелиальной системы. Распад гемоглобина начинается с действия гем-оксигеназы с разрушением
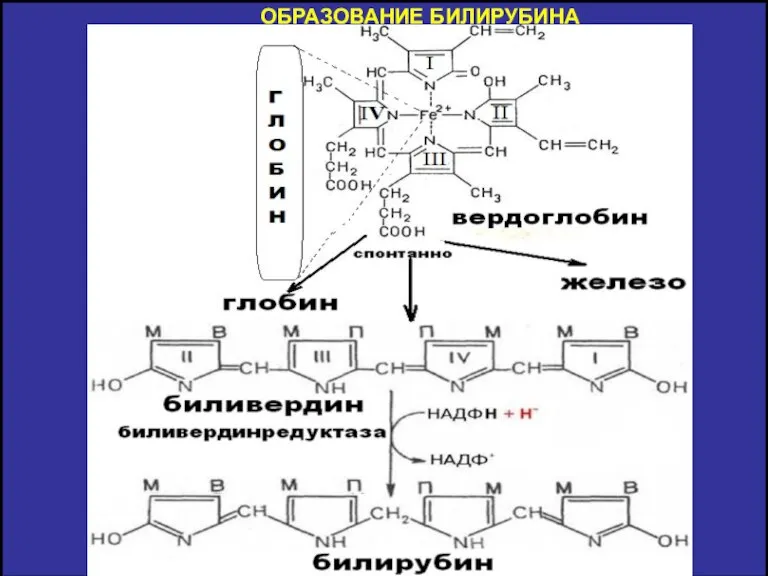
- 11. ОБРАЗОВАНИЕ БИЛИРУБИНА
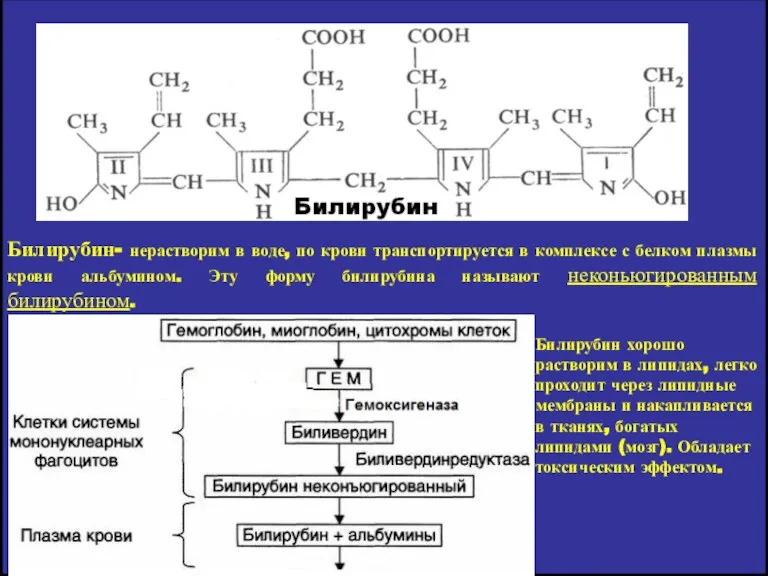
- 12. Билирубин- нерастворим в воде, по крови транспортируется в комплексе с белком плазмы крови альбумином. Эту форму
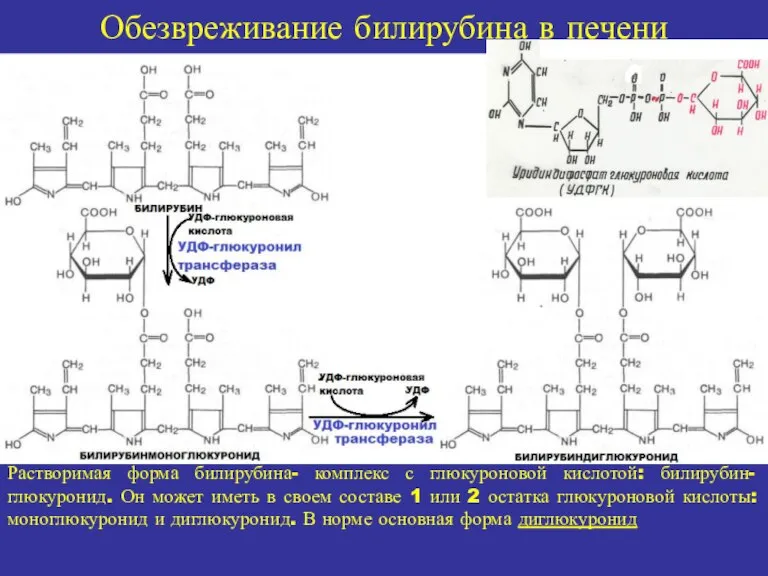
- 13. Обезвреживание билирубина в печени Растворимая форма билирубина- комплекс с глюкуроновой кислотой: билирубин-глюкуронид. Он может иметь в
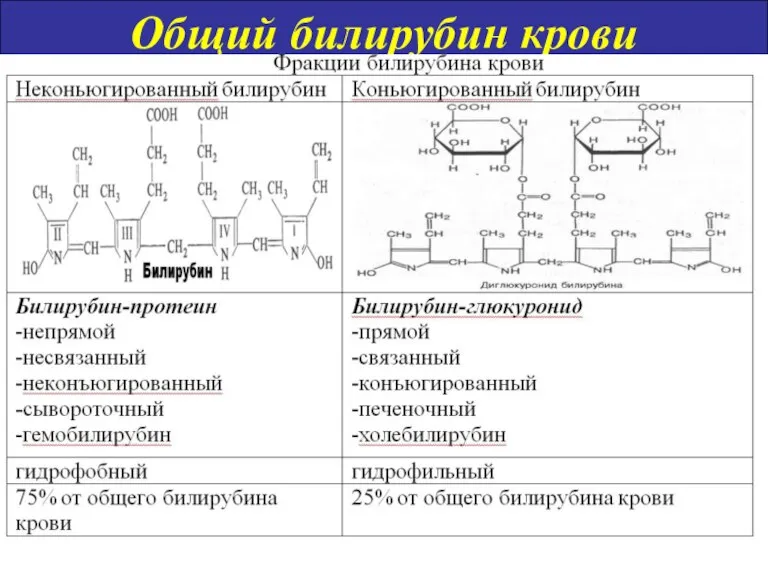
- 14. Общий билирубин крови
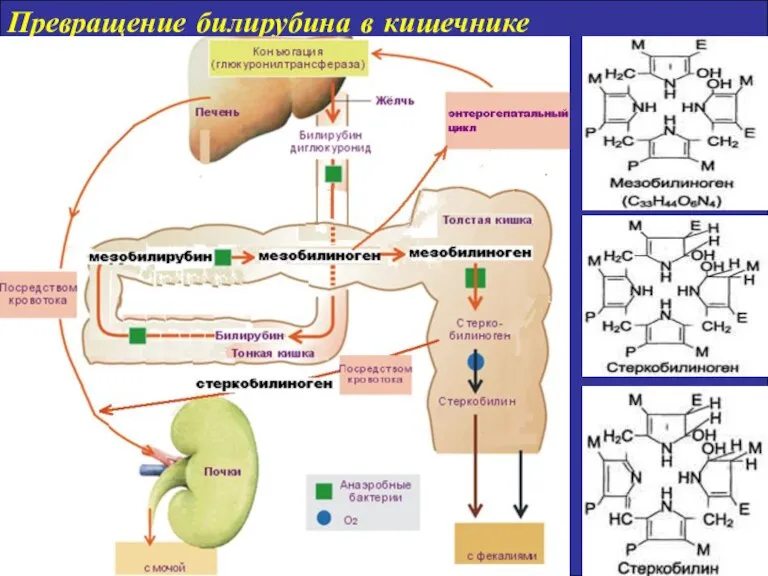
- 15. Превращение билирубина в кишечнике
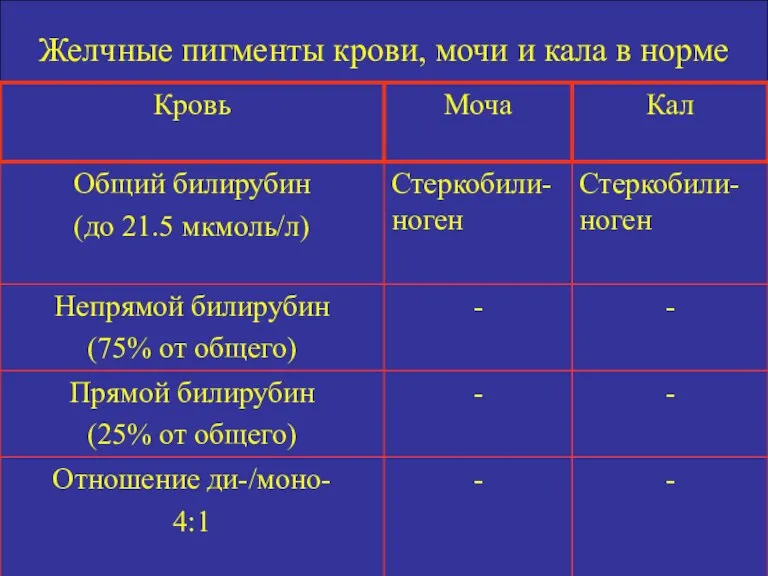
- 16. Желчные пигменты крови, мочи и кала в норме
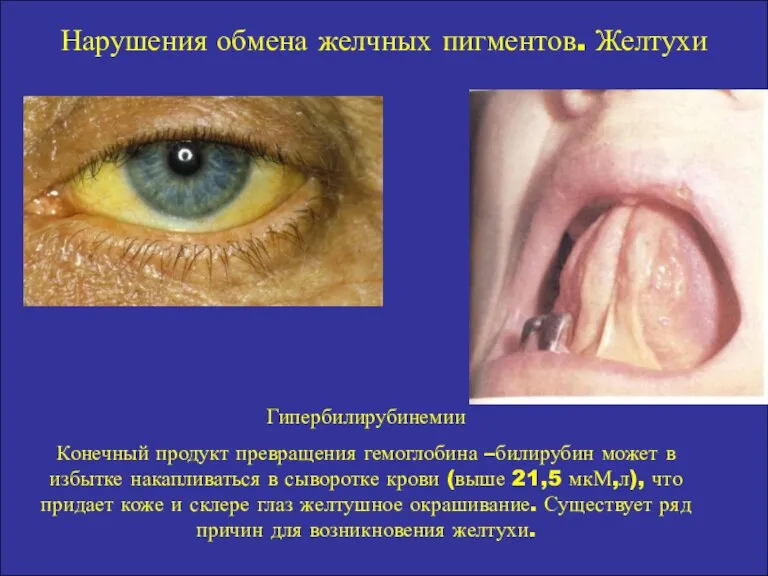
- 17. Нарушения обмена желчных пигментов. Желтухи Гипербилирубинемии Конечный продукт превращения гемоглобина –билирубин может в избытке накапливаться в
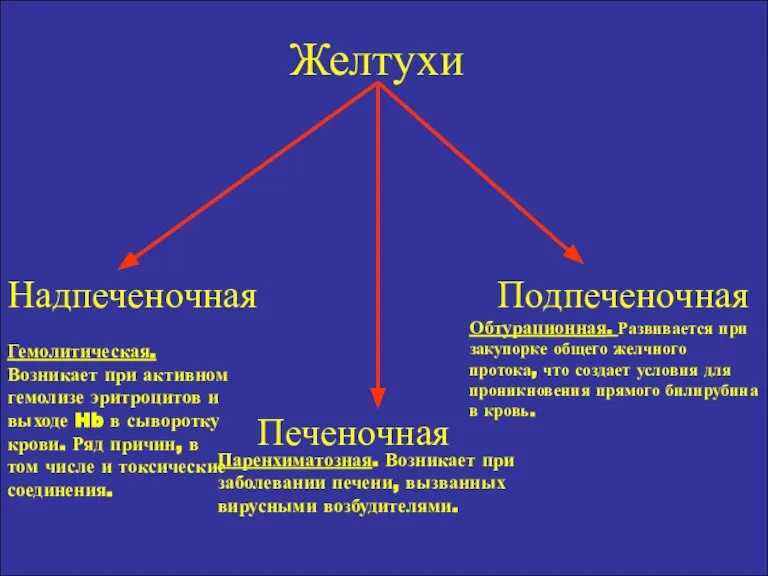
- 18. Желтухи Надпеченочная Подпеченочная Печеночная Гемолитическая. Возникает при активном гемолизе эритроцитов и выходе Hb в сыворотку крови.
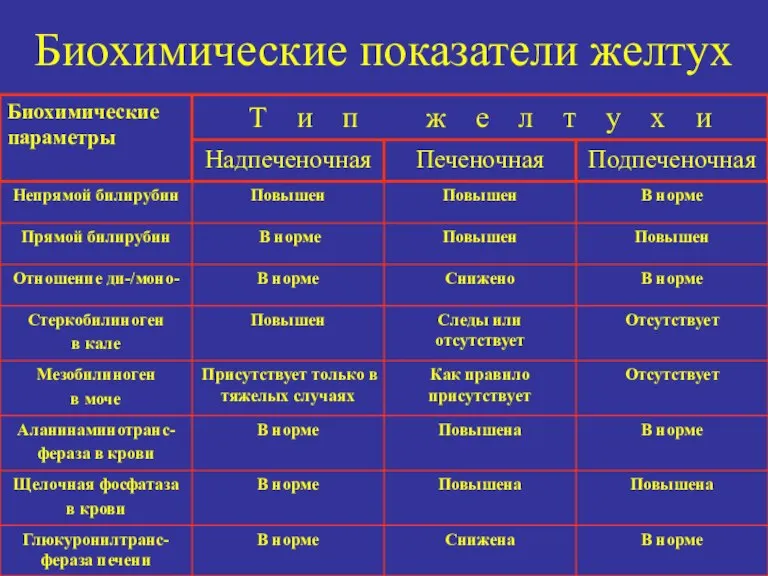
- 19. Биохимические показатели желтух
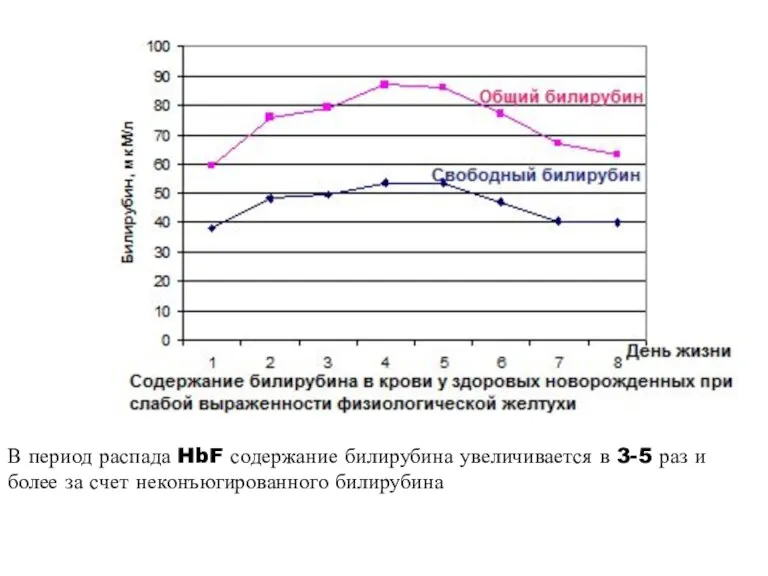
- 20. В период распада HbF содержание билирубина увеличивается в 3-5 раз и более за счет неконъюгированного билирубина
- 21. Желтуха новорожденных У новорожденных в момент рождения содержание БЛ в крови в 2 раза выше чем
- 22. Наследственные нарушения метаболизма билирубина Синдром Жильбера - это наследственное заболевание, которое проявляется постоянным или периодическим повышением
- 23. БИОТРАНСФОРМАЦИЯ, как молекулярный путь антитоксической функции печени
- 24. Ксенобиотики- вещества, поступающие из окружающей среды и не используемые организмом для образования энергии или построения тканей.
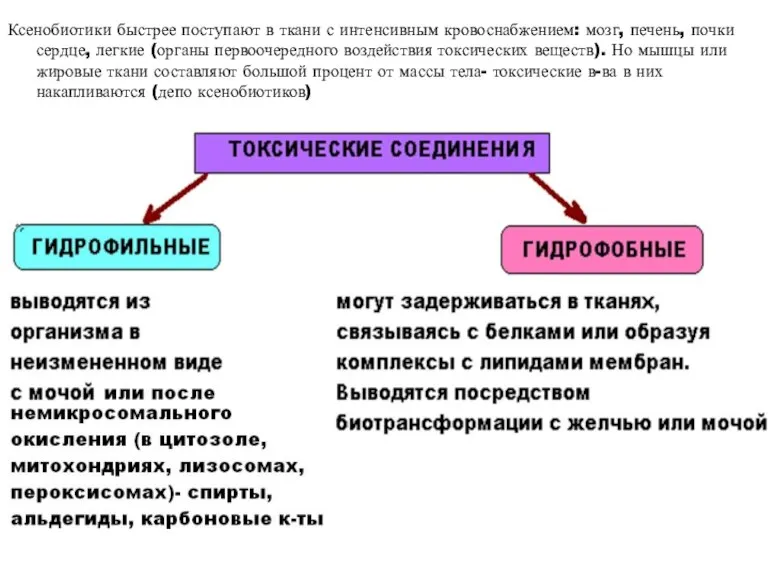
- 25. Ксенобиотики быстрее поступают в ткани с интенсивным кровоснабжением: мозг, печень, почки сердце, легкие (органы первоочередного воздействия
- 26. Биотрансформация - это комплекс процессов, которые обеспечивают антитоксическую функцию печени. Антитоксическая функция печени - это обезвреживание
- 27. 1фаза: Несинтетическая- прямое метаболическое превращение с образованием конечных продуктов или в дальнейшем подвергающихся коньюгации -окисление -восстановления
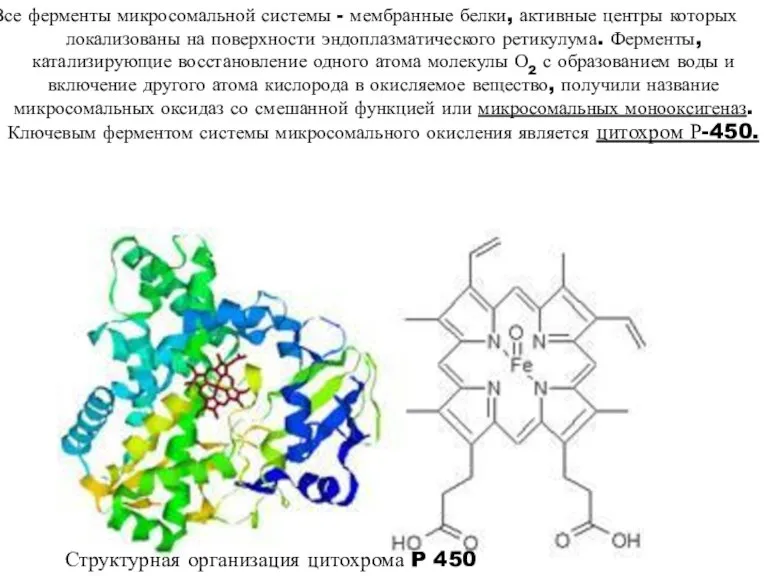
- 28. Структурная организация цитохрома P 450 Все ферменты микросомальной системы - мембранные белки, активные центры которых локализованы
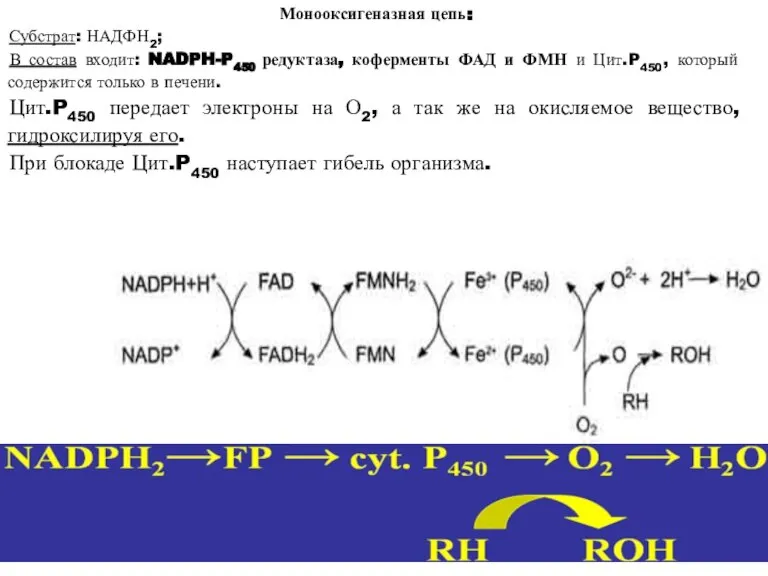
- 29. Монооксигеназная цепь: Субстрат: НАДФН2; В состав входит: NADPH-P450 редуктаза, коферменты ФАД и ФМН и Цит.P450, который
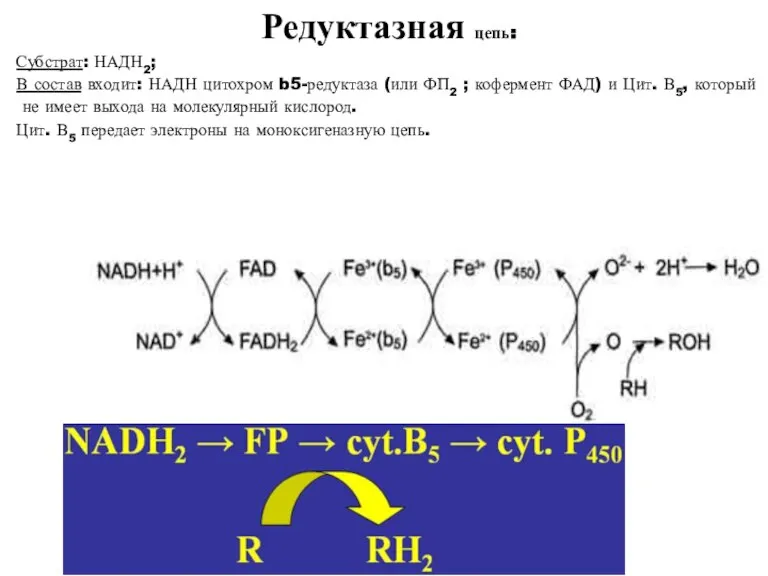
- 30. Редуктазная цепь: Субстрат: НАДН2; В состав входит: НАДН цитохром b5-редуктаза (или ФП2 ; кофермент ФАД) и
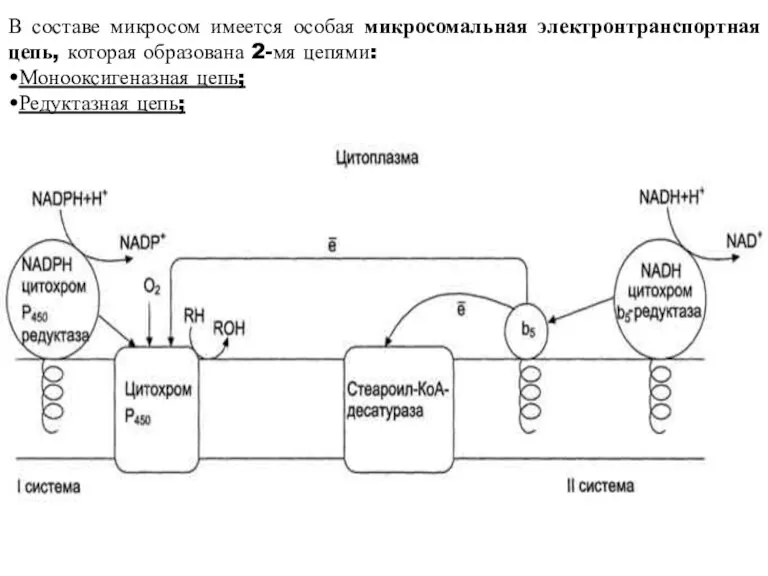
- 31. В составе микросом имеется особая микросомальная электронтранспортная цепь, которая образована 2-мя цепями: •Монооксигеназная цепь; •Редуктазная цепь;
- 32. Внемикросомальные процессы – включают реакции окисления, восстановления и гидролиза, совершающиеся в цитоплазме, лизосомах, пероксисомах и др.
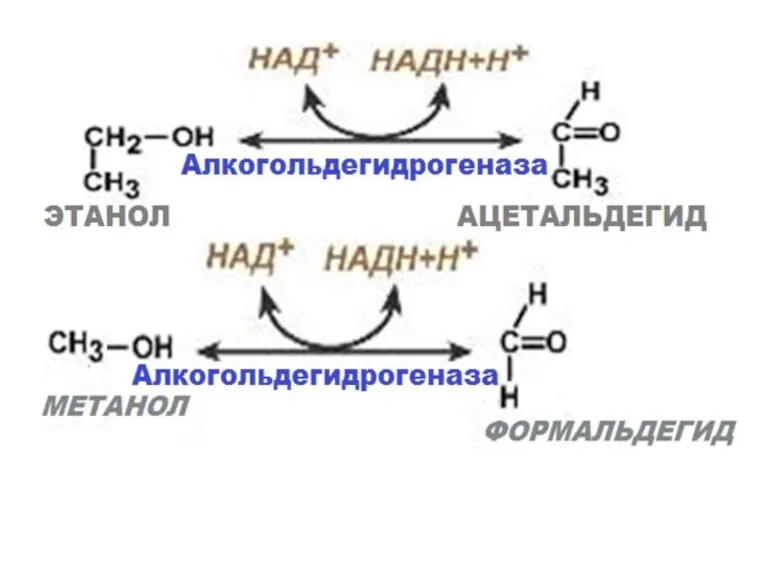
- 33. В цитоплазме особую роль играет фермент алкогольдегидрогеназа (АДГ), при участии которого происходит окисление этилового и других
- 35. 2 фаза. Синтетическая или Конъюгация: в реакциях второй фазы модифицированные в ходе первого этапа биотрансформации ксенобиотики
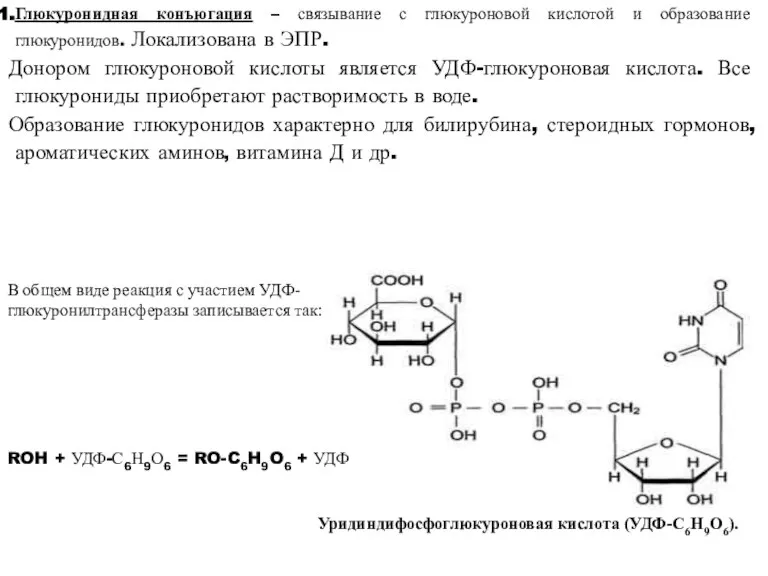
- 36. Глюкуронидная конъюгация – связывание с глюкуроновой кислотой и образование глюкуронидов. Локализована в ЭПР. Донором глюкуроновой кислоты
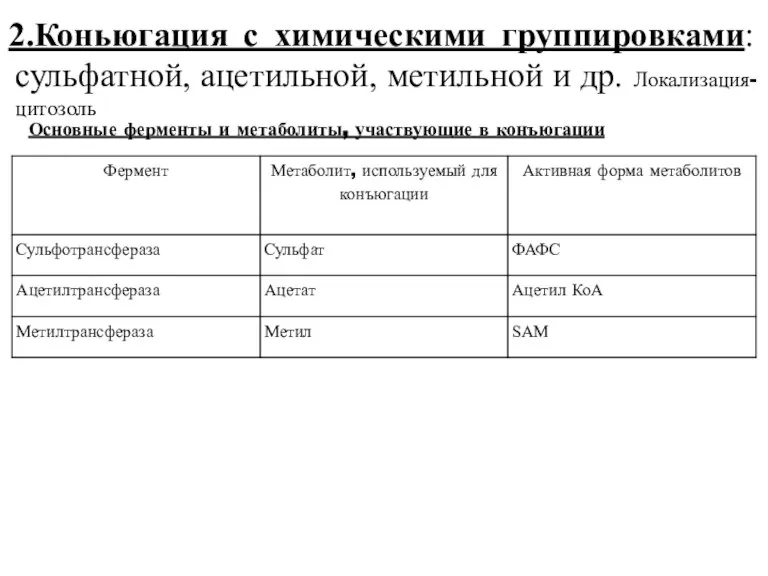
- 37. 2.Коньюгация с химическими группировками: сульфатной, ацетильной, метильной и др. Локализация-цитозоль Основные ферменты и метаболиты, участвующие в
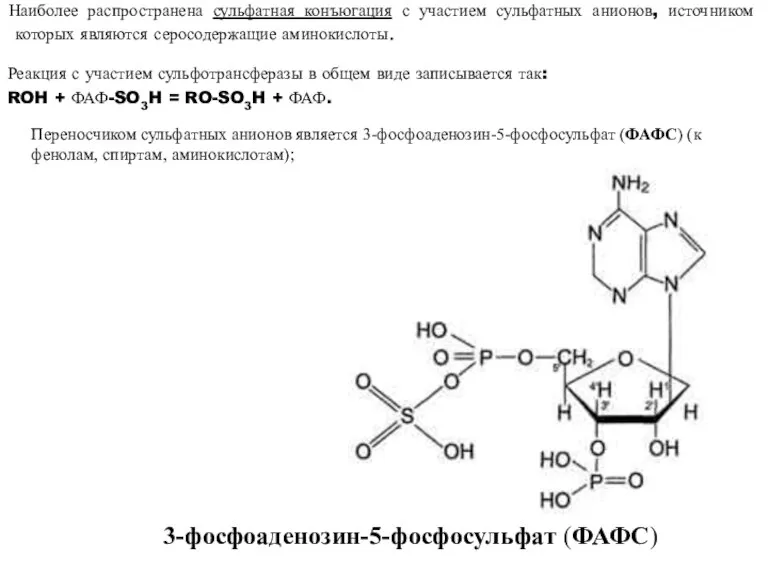
- 38. 3-фосфоаденозин-5-фосфосульфат (ФАФС) Переносчиком сульфатных анионов является 3-фосфоаденозин-5-фосфосульфат (ФАФС) (к фенолам, спиртам, аминокислотам); Наиболее распространена сульфатная конъюгация
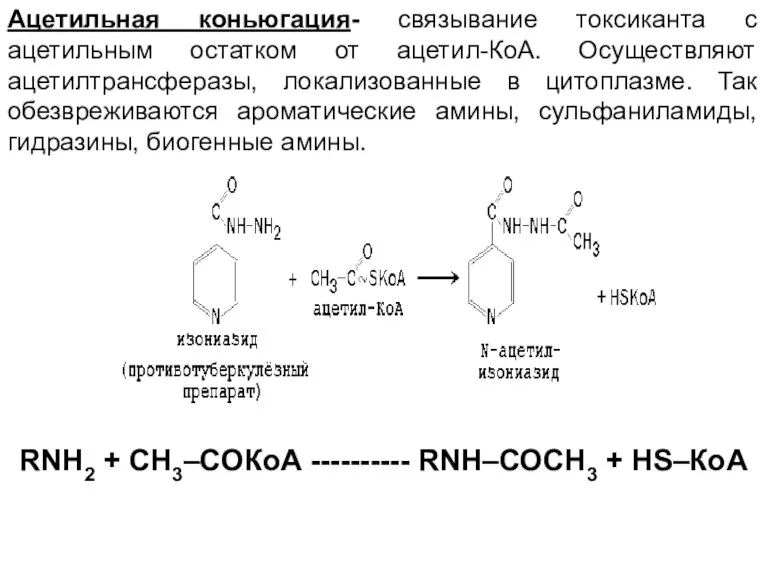
- 39. Ацетильная коньюгация- связывание токсиканта с ацетильным остатком от ацетил-КоА. Осуществляют ацетилтрансферазы, локализованные в цитоплазме. Так обезвреживаются
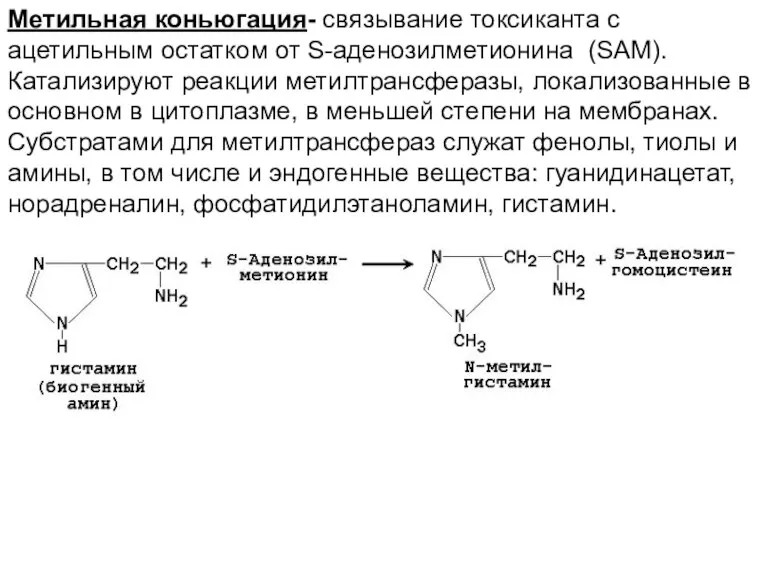
- 40. Метильная коньюгация- связывание токсиканта с ацетильным остатком от S-аденозилметионина (SAM). Катализируют реакции метилтрансферазы, локализованные в основном
- 41. 3.Глутатионовая защита, которая включает участие глутатиона, а так же ферментов глутатионтрансферазы, глутатионредуктазы и глутатионпероксидазы. ГТ играют
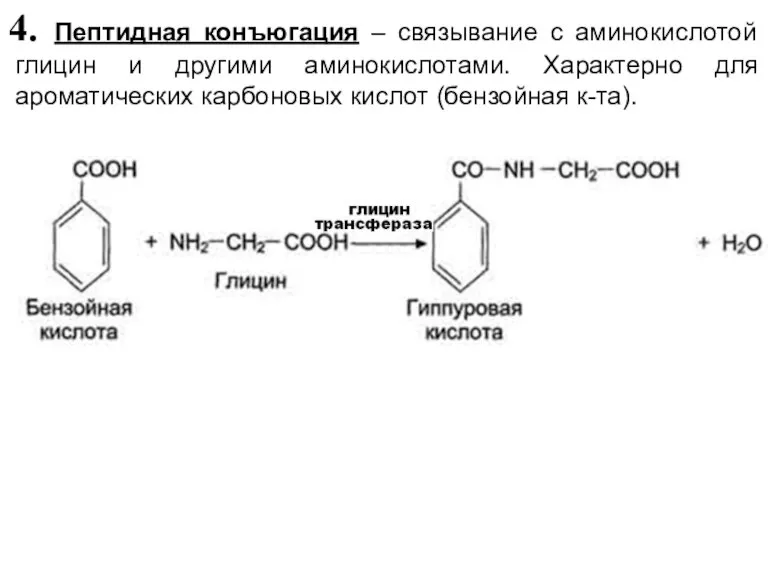
- 42. 4. Пептидная конъюгация – связывание с аминокислотой глицин и другими аминокислотами. Характерно для ароматических карбоновых кислот
- 43. 5. Тиоционатная конъюгация - для обезвреживания эндогенного цианистого иона;
- 44. Наиболее существенными процессами в биотрансформации считается: • Глюкуронидная конъюгация; • Сульфатная конъюгация; • Глутатионовая конъюгация
- 45. Клиническая оценка процесса биотрансформации. 1 фаза оценивается по: Антипириновая проба на Цитохром Р450; АДГ-активность как тест
- 46. 2 фаза оценивается в основном по глутатионовой защите: Содержание глутатиона в его окисленной и восстановленной форме;
- 47. ФАКТОРЫ, ВЛИЯЮЩИЕ НА БИОТРАНСФОМАЦИЮ ВОЗРАСТНЫЕ РАЗЛИЧИЯ 2) ВИДОВЫЕ РАЗЛИЧИЯ 3) ГЕНЕТИЧЕСКИЕ РАЗЛИЧИЯ 4)ПОЛОВЫЕ РАЗЛИЧИЯ 5) ДЕЙСТВИЕ
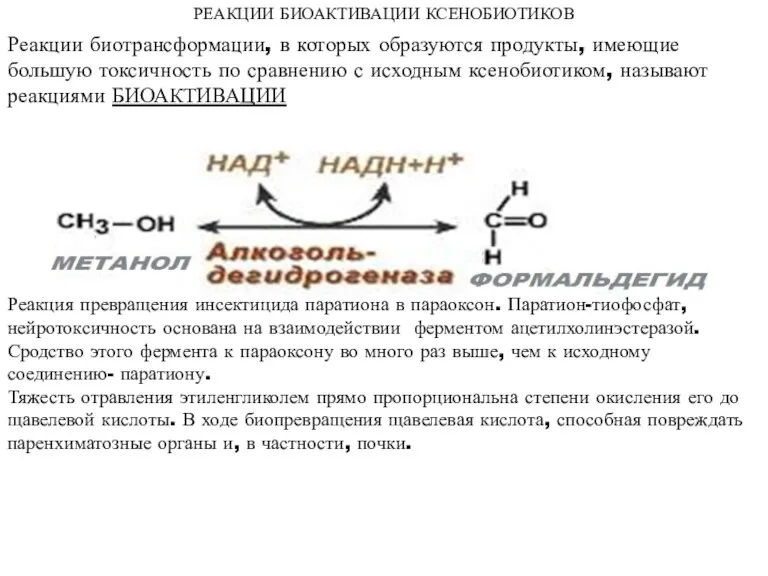
- 48. РЕАКЦИИ БИОАКТИВАЦИИ КСЕНОБИОТИКОВ Реакции биотрансформации, в которых образуются продукты, имеющие большую токсичность по сравнению с исходным
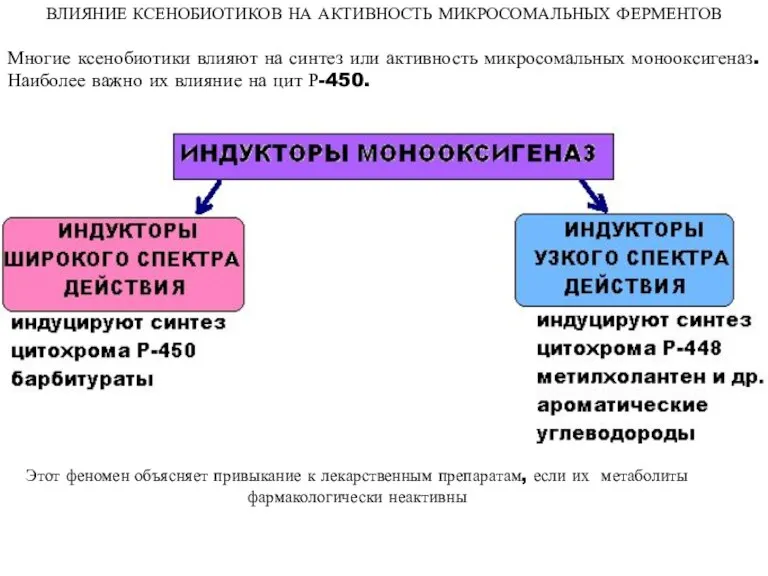
- 49. ВЛИЯНИЕ КСЕНОБИОТИКОВ НА АКТИВНОСТЬ МИКРОСОМАЛЬНЫХ ФЕРМЕНТОВ Многие ксенобиотики влияют на синтез или активность микросомальных монооксигеназ. Наиболее
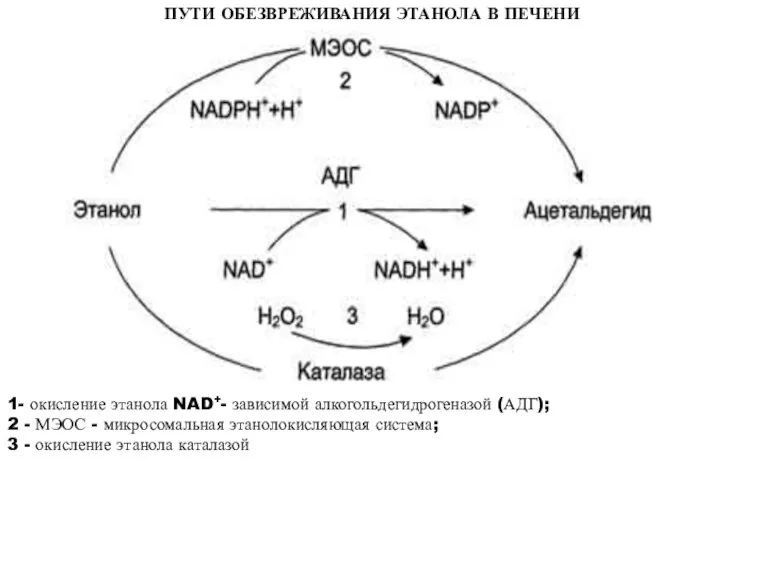
- 50. ПУТИ ОБЕЗВРЕЖИВАНИЯ ЭТАНОЛА В ПЕЧЕНИ 1- окисление этанола NAD+- зависимой алкогольдегидрогеназой (АДГ); 2 - МЭОС -
- 51. Цитохром Р450-зависимая микросомальная этанолокисляющая система (МЭОС) локализована в мембране гладкого ЭР гепатоцитов. МЭОС играет незначительную роль
- 53. Скачать презентацию






















 Интерпретация компьютерной томографии
Интерпретация компьютерной томографии Цирроз печени и гепатиты
Цирроз печени и гепатиты Что я знаю о своей профессии?
Что я знаю о своей профессии? Формирование мотиваций на здоровый образ жизни
Формирование мотиваций на здоровый образ жизни Оценка физического, психо-эмоционального и социально-коммуникативного здоровья учащихся общеобразовательной школы
Оценка физического, психо-эмоционального и социально-коммуникативного здоровья учащихся общеобразовательной школы Экстракардиальные и интракардиальные предшественики для регенерации миокарда
Экстракардиальные и интракардиальные предшественики для регенерации миокарда Патофизиология опухолевого роста
Патофизиология опухолевого роста Болезни шейного отдела позвоночника и их решения в Нуга Бест
Болезни шейного отдела позвоночника и их решения в Нуга Бест Сравнительный фармакоэкономический анализ лекарственной терапии острой декомпенсации сердечной недостаточности в России
Сравнительный фармакоэкономический анализ лекарственной терапии острой декомпенсации сердечной недостаточности в России Профилактика туберкулеза лекция 4
Профилактика туберкулеза лекция 4 Факторы риска неинфекционных заболеваний, увеличивающие вероятность ухудшения здоровья подростков и молодежи
Факторы риска неинфекционных заболеваний, увеличивающие вероятность ухудшения здоровья подростков и молодежи Профессиональная деятельность акушерки при ведении беременности и родов у ВИЧ-инфицированных
Профессиональная деятельность акушерки при ведении беременности и родов у ВИЧ-инфицированных Случаи применения биологического оружия в истории человечества
Случаи применения биологического оружия в истории человечества Бронхиальды астма терапиясының фармакоэкономикасы
Бронхиальды астма терапиясының фармакоэкономикасы Клиника Алмаз
Клиника Алмаз Лечебно-охранительный режим и его компоненты
Лечебно-охранительный режим и его компоненты Профилактика заболеваний в школе: 10 шагов к здоровью школьника
Профилактика заболеваний в школе: 10 шагов к здоровью школьника Тіс қандай бөлімдерден тұрады?
Тіс қандай бөлімдерден тұрады? Гипертонические препараты
Гипертонические препараты Teма № 6 Первая помощь
Teма № 6 Первая помощь Местные и общие проявления воспаления
Местные и общие проявления воспаления История развития больничного строительства и современная классификация медицинских организаций
История развития больничного строительства и современная классификация медицинских организаций Хроническая сердечная недостаточность
Хроническая сердечная недостаточность Индивидуальная гигиена полости рта у пациентов с имплантантами
Индивидуальная гигиена полости рта у пациентов с имплантантами Инструментальные методы диагностики миеломной болезни
Инструментальные методы диагностики миеломной болезни Синдром ранней реполяризации желудочков. Гипертрофия
Синдром ранней реполяризации желудочков. Гипертрофия Аллергические и аутоиммунные заболевания в терапии
Аллергические и аутоиммунные заболевания в терапии Транспортная иммобилизация при травмах
Транспортная иммобилизация при травмах