Содержание
- 2. АКТУАЛЬНОСТЬ Медицинские препараты (препараты комплексного действия, иммуноглобулины и гемостатические препараты)из крови могут представлять угрозу для здоровья
- 3. Для производства препаратов крови человека используется плазма крови здоровых доноров, соответствующая требованиям ФС «Плазма человека для
- 4. Производство должно гарантировать сохранение структуры и функции белков крови, обеспечивать специфическую и вирусную безопасность препаратов и
- 5. ИНДИВИДУАЛЬНАЯ ЕДИНИЦА ПЛАЗМЫ Перед формированием производственного пула (загрузки) индивидуальные единицы плазмы объединяют для проведения испытаний по
- 6. ПРОЦЕССЫ ВИРУСНОЙ ИНАКТИВАЦИИ ИЛИ ЭЛИМИНАЦИИ При необходимости вирусной элиминации и (или) инактивации, исходное сырье и материалы
- 7. Способы, используемые для инактивации вирусов в препаратах крови
- 8. Способы, используемые для инактивации вирусов в препаратах крови
- 9. Способы, используемые для инактивации вирусов в препаратах крови
- 10. Способы, используемые для инактивации вирусов в препаратах крови
- 11. ВИРУСНАЯ БЕЗОПАСНОСТЬ Поверхностный антиген (HBsAg) и нуклеиновая кислота вируса гепатита В Должны отсутствовать.
- 12. Антитела к вирусу иммунодефицита человека (ВИЧ-1, ВИЧ-2) и нуклеиновая кислота вируса иммунодефицита человека Должны отсутствовать. ВИРУСНАЯ
- 13. ВИРУСНАЯ БЕЗОПАСНОСТЬ Антитела к вирусу гепатита С и нуклеиновая кислота вируса гепатита С Должны отсутствовать.
- 14. Антитела к возбудителю сифилиса Должны отсутствовать. ВИРУСНАЯ БЕЗОПАСНОСТЬ
- 15. Характеристика требований российских и международных (Европейской фармакопеи) стандартов качества
- 16. Характеристика требований российских и международных (Европейской фармакопеи) стандартов качества
- 17. Таким образом, нужно уделять особое внимание оценке рисков вирусной контаминации и очистке от вирусов продукта, используя
- 19. Скачать презентацию
















 Психологиялық зерттеу әдістері
Психологиялық зерттеу әдістері Аутоиммунные заболевания
Аутоиммунные заболевания История переливания крови
История переливания крови Сілекей бездері, анатомиясы. Сілекей бездерінің қатерлі ісіктері
Сілекей бездері, анатомиясы. Сілекей бездерінің қатерлі ісіктері Вирус А H1N1
Вирус А H1N1 Вегетативная нервная система
Вегетативная нервная система Препараты, стимулирующие гуморальное звено
Препараты, стимулирующие гуморальное звено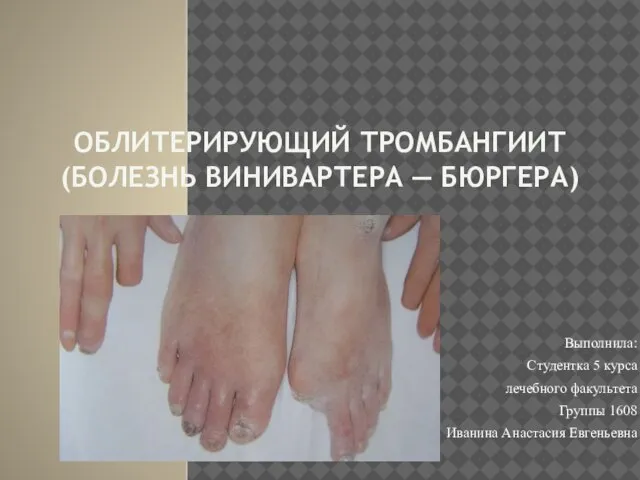 Облитерирующий тромбангиит (болезнь Винивартера — Бюргера)
Облитерирующий тромбангиит (болезнь Винивартера — Бюргера) Лечение артериальной гипертензии и гипертонического криза у беременных
Лечение артериальной гипертензии и гипертонического криза у беременных Инфекционные заболевания
Инфекционные заболевания Деформации челюстей . Клинические проявления и диагностика
Деформации челюстей . Клинические проявления и диагностика Инфаркт миокарда правого желудочка. Особенности клиники, диагностики
Инфаркт миокарда правого желудочка. Особенности клиники, диагностики ХОБЛ 3 курс 2019
ХОБЛ 3 курс 2019 Пилоростеноз
Пилоростеноз Медицинская аптечка
Медицинская аптечка Трахеостомия в ОРИТ
Трахеостомия в ОРИТ Пузырные дерматозы
Пузырные дерматозы Первая помощь при переломах
Первая помощь при переломах Иммунитет. Активная иммунизация
Иммунитет. Активная иммунизация Семейная терапия в РЦ Здоровое поколение
Семейная терапия в РЦ Здоровое поколение Опухоль Вильмса
Опухоль Вильмса Врожденные пороки сердца. Острая ревматическая лихорадка
Врожденные пороки сердца. Острая ревматическая лихорадка Геронтология – адамның және жануарлар организмінің қартаю заңдылықтарын зерттейтін ғылым
Геронтология – адамның және жануарлар организмінің қартаю заңдылықтарын зерттейтін ғылым Терапия депрессивных и тревожных расстройств
Терапия депрессивных и тревожных расстройств Электрическая стимуляция сердца. Модель проводящей системы сердца. (Лекция 2)
Электрическая стимуляция сердца. Модель проводящей системы сердца. (Лекция 2) Транзиторно-ишемическая атака
Транзиторно-ишемическая атака Аускультация легких. Лекция 4
Аускультация легких. Лекция 4 Иммунитет против туберкулеза
Иммунитет против туберкулеза