Содержание
- 2. Органическая химия – это химия углеводородов и их производных.
- 4. Теоретические основы органической химии Теория строения А. М. Бутлерова Основные положения 1.Химическая природа сложной молекулы определяется
- 5. 3. Химическое строение веществ определяет их химические и физические свойства; 4. Химическое строение веществ может быть
- 6. Химическая связь в органических соединениях
- 7. Теория Льюиса и Косселя: 1.Связь между атомами осуществляется парой валентных электронов. 2.Атомы, входящие в молекулы, стремятся
- 8. Электронный октет (или дублет) может образоваться за счет: Переноса электронов (ионная связь). 2. Обобществления электронов (ковалентная
- 9. Способы образования ковалентной связи 1. За счет обобществления неспаренных электронов, предоставляемых обоими атомами:
- 10. 2. За счет пары электронов, предоставленных одним из атомов. Атом, предоставляющий электроны, называется донором. Атом, принимающий
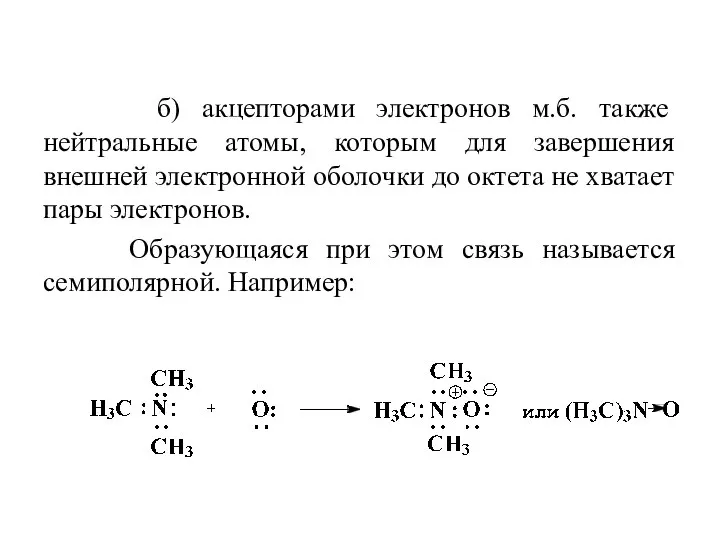
- 11. б) акцепторами электронов м.б. также нейтральные атомы, которым для завершения внешней электронной оболочки до октета не
- 12. Ковалентная связь по способу перекрывания атомных орбиталей делится на сигма(Ϭ) и Пи (π) связи. Сигма-связь образуется
- 13. Гибридизация атомных орбиталей углерода Гибридизация – это процесс смешения нескольких различных атомных орбиталей с образованием такого
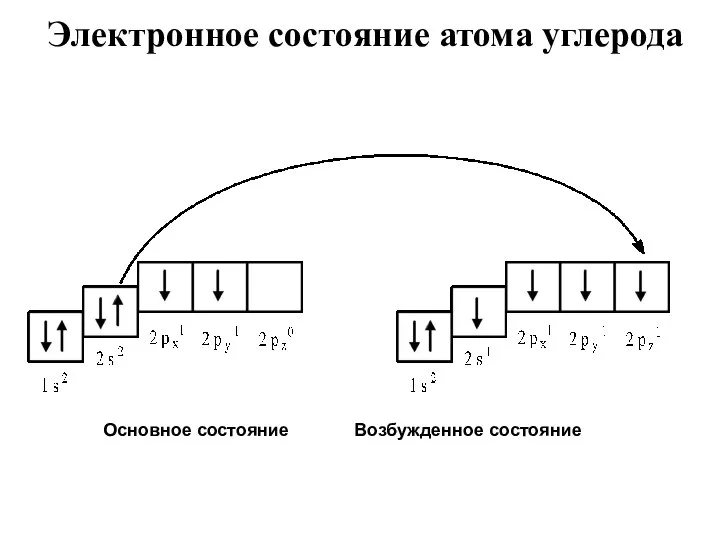
- 14. Электронное состояние атома углерода Основное состояние Возбужденное состояние
- 15. Представленные электронные состояния объясняют причину 4-х валентности атома углерода (имеется 4 одноэлектронных орбитали). Но не объясняют
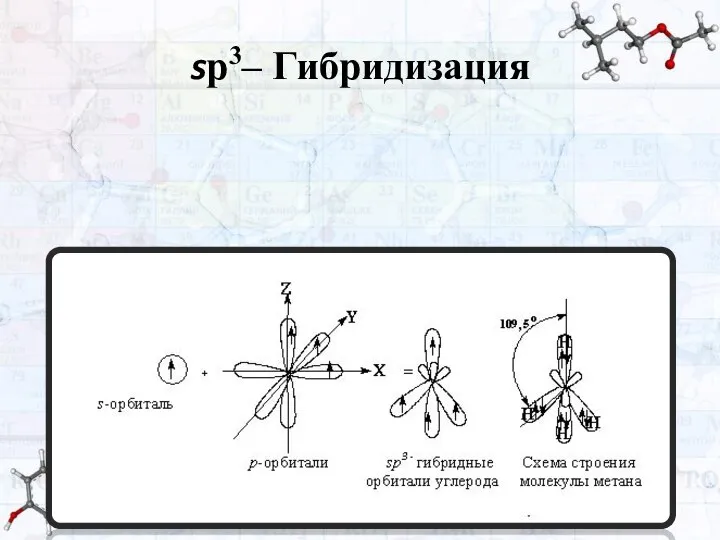
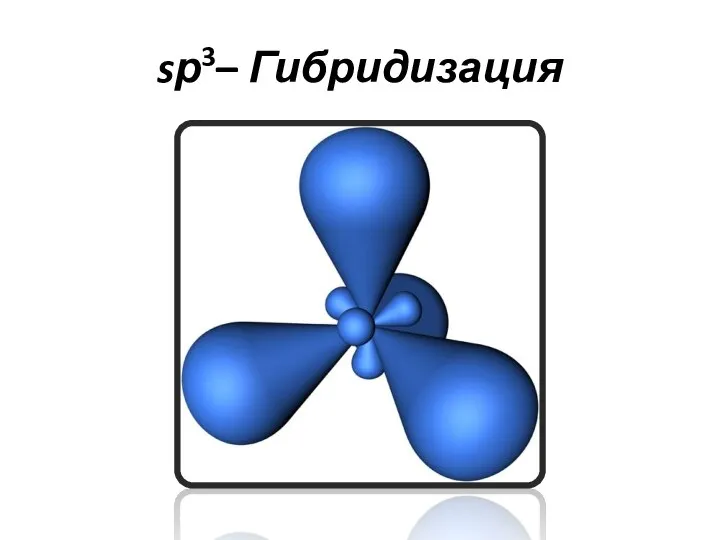
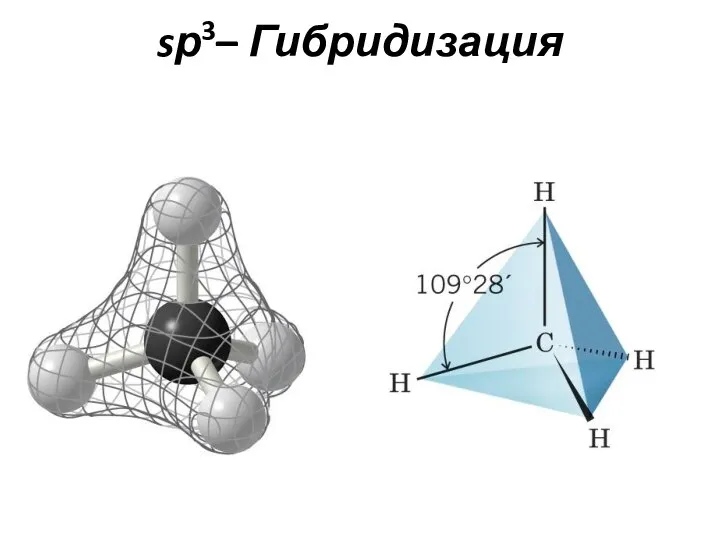
- 16. Типы гибридизации Существует три типа гибридизации: sр–; sр2– и sр3– Гибридизации. sр3– Гибридизация В образовании sр3–
- 17. sр3– Гибридизация реализуется в соединениях с одинарной связью (-). Рассмотрим участие sр3– Гибридных орбиталей в образовании
- 18. sр3– Гибридизация
- 19. sр3– Гибридизация
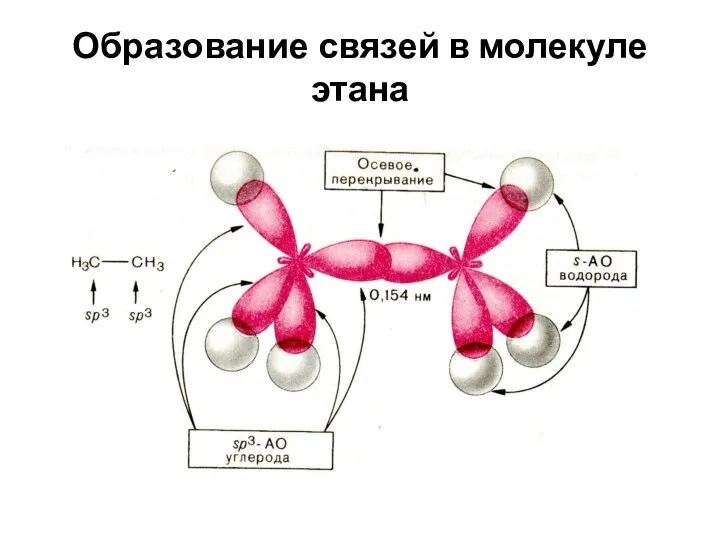
- 20. Образование связей в молекуле этана
- 21. sр3– Гибридизация
- 22. sр2– Гибридизация В образовании sр2– гибридных орбиталей участвуют 1 s- и 2 р-орбитали. В результате гибридизации
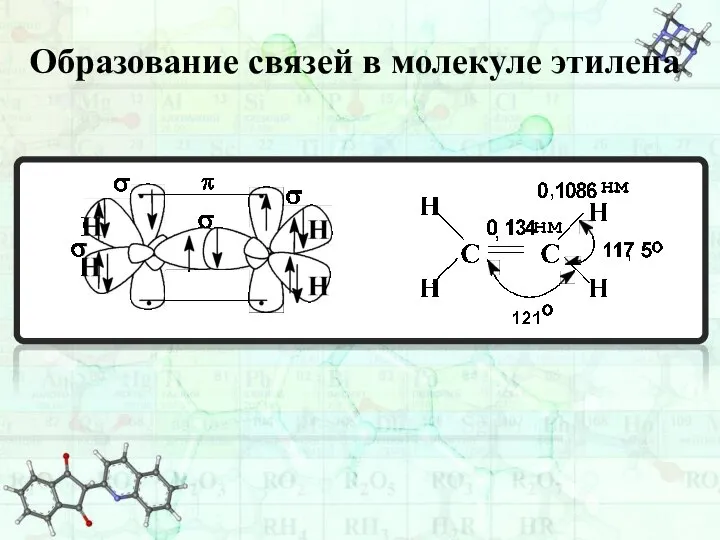
- 23. sр2– Гибридизация реализуется в соединениях с двойной связью. Рассмотрим образование двойной связи на примере молекулы этилена
- 24. Образование связей в молекуле этилена
- 25. sр– Гибридизация В образовании sр– гибридных орбиталей участвуют 1 s- и 1 р-орбитали. В результате гибридизации
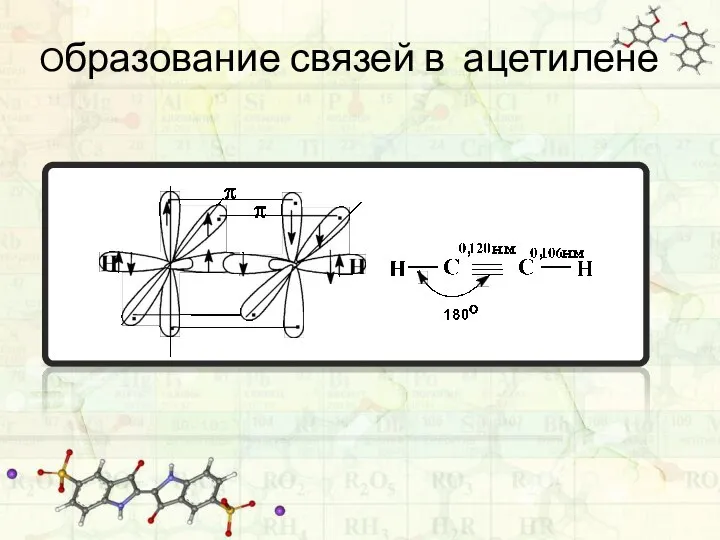
- 26. sр– Гибридизация реализуется в соединениях с тройной связью. Рассмотрим образование тройной связи на примере молекулы ацетилена
- 27. Образование связей в ацетилене
- 28. Гибридизация атомных орбиталей гетероатомов на примере кислорода и азота Гибридизация атомных орбиталей гетероатомов происходит аналогично гибридизации
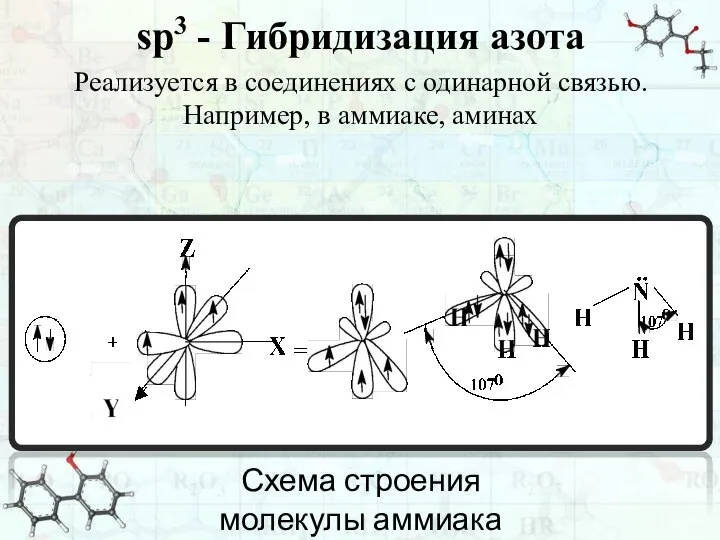
- 29. sp3 - Гибридизация азота Реализуется в соединениях с одинарной связью. Например, в аммиаке, аминах Схема строения
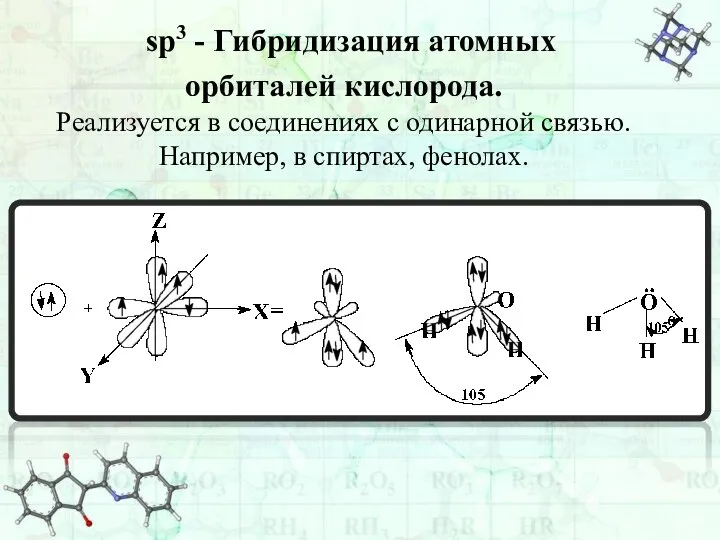
- 30. sp3 - Гибридизация атомных орбиталей кислорода. Реализуется в соединениях с одинарной связью. Например, в спиртах, фенолах.
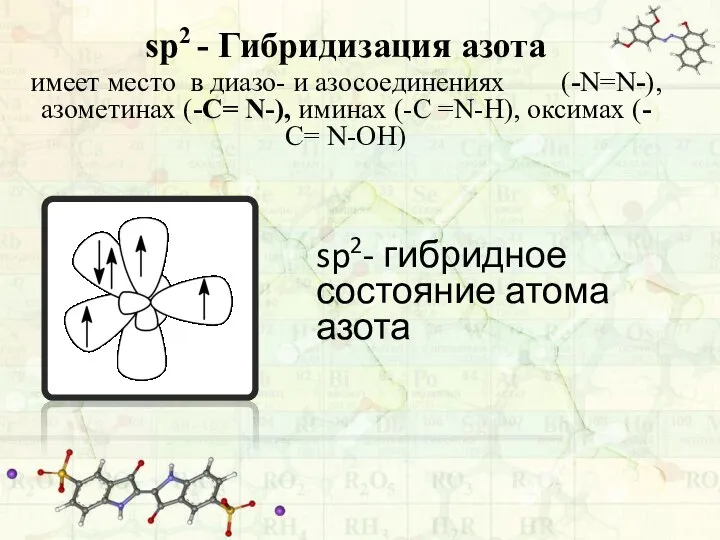
- 31. sp2 - Гибридизация азота имеет место в диазо- и азосоединениях (-N=N-), азометинах (-С= N-), иминах (-С
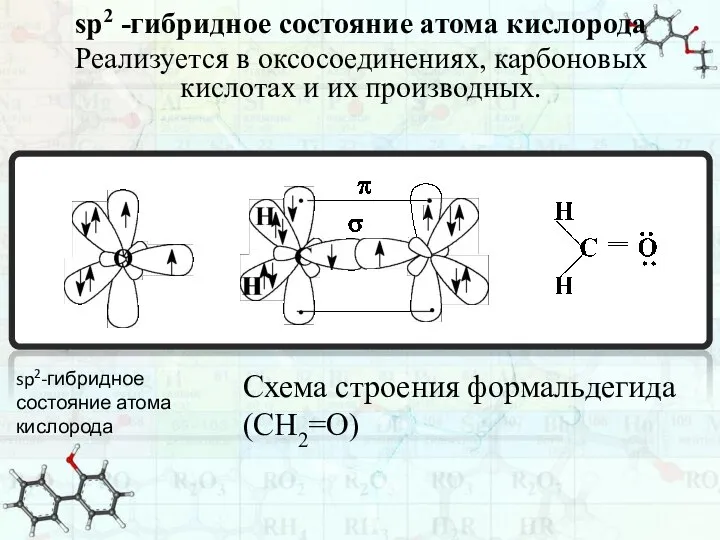
- 32. sp2 -гибридное состояние атома кислорода Реализуется в оксосоединениях, карбоновых кислотах и их производных. sp2-гибридное состояние атома
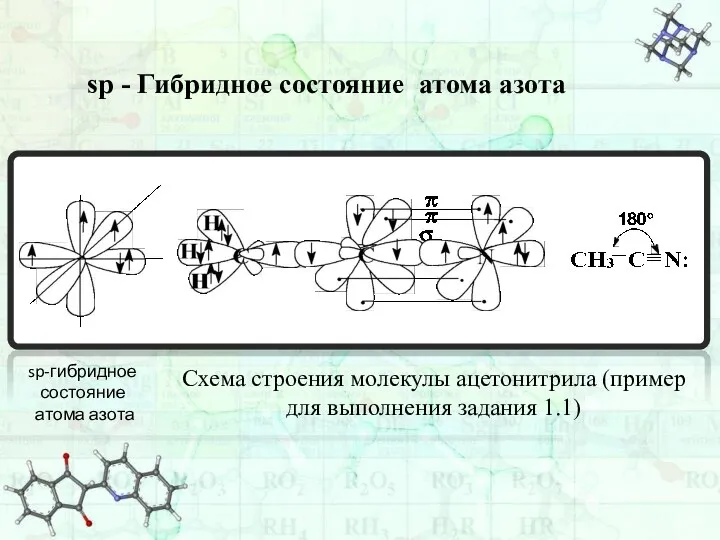
- 33. sp - Гибридное состояние атома азота sp-гибридное состояние атома азота Схема строения молекулы ацетонитрила (пример для
- 34. Электроотрицательность атомов и поляризация связи Электроотрицательностью атомов называется способность атома притягивать на себя электронную плотность от
- 35. Механизмы распределения электронной плотности в молекулах органических соединений Перераспределение электронной плотности в молекулах органических соединений происходит
- 36. Индукционный эффект (I) Индукционный эффект (I)– это передача влияния заместителей путем последовательной поляризации Ϭ-связей. Смещение электронной
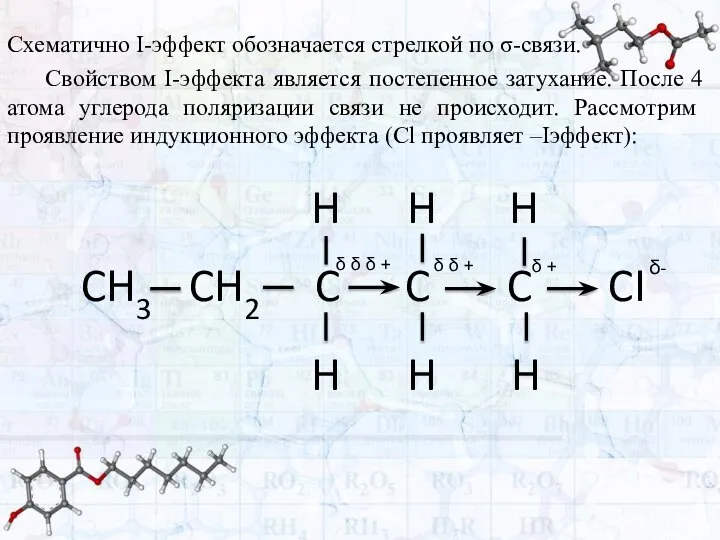
- 37. Схематично I-эффект обозначается стрелкой по σ-связи. Свойством I-эффекта является постепенное затухание. После 4 атома углерода поляризации
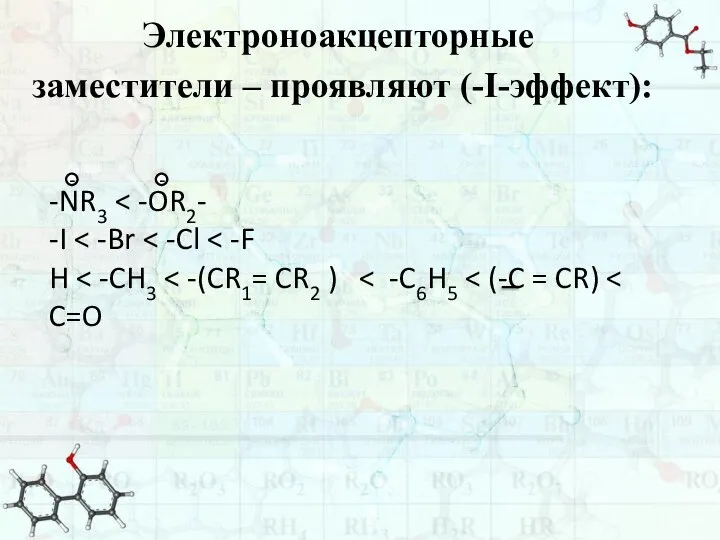
- 38. Электроноакцепторные заместители – проявляют (-I-эффект): -NR3 -I H - -
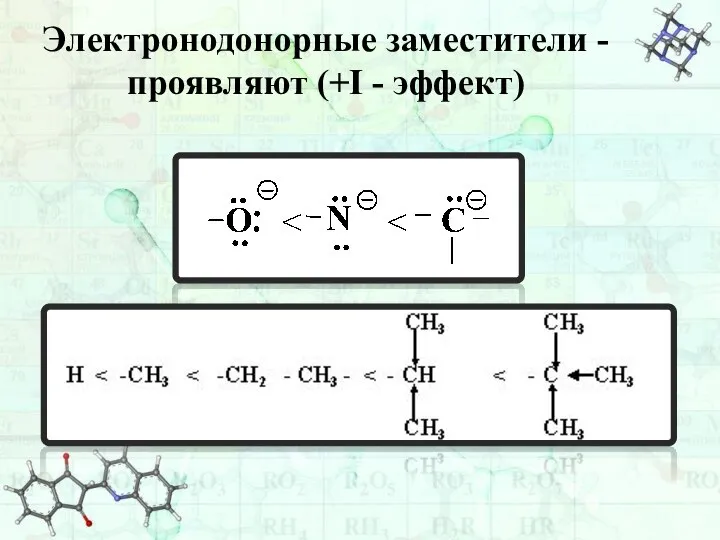
- 39. Электронодонорные заместители - проявляют (+I - эффект)
- 40. Мезомерный эффект (М) (эффект сопряжения) Мезомерный эффект – это перераспределение электронной плотности в молекуле органического соединения
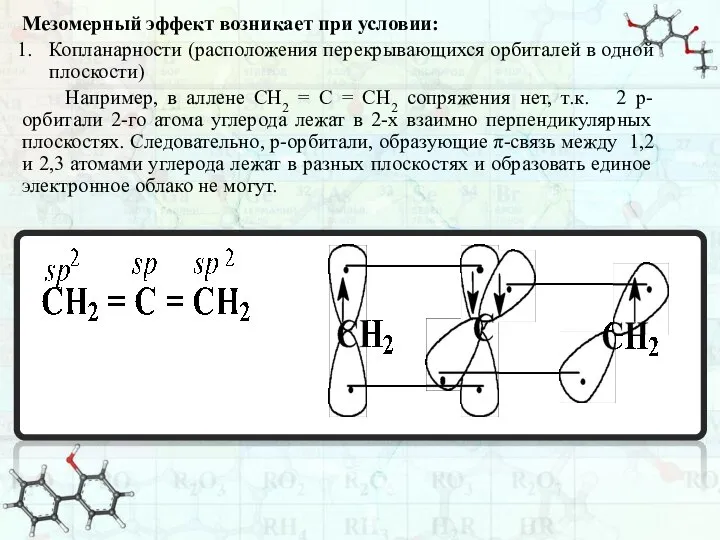
- 41. Мезомерный эффект возникает при условии: Копланарности (расположения перекрывающихся орбиталей в одной плоскости) Например, в аллене СН2
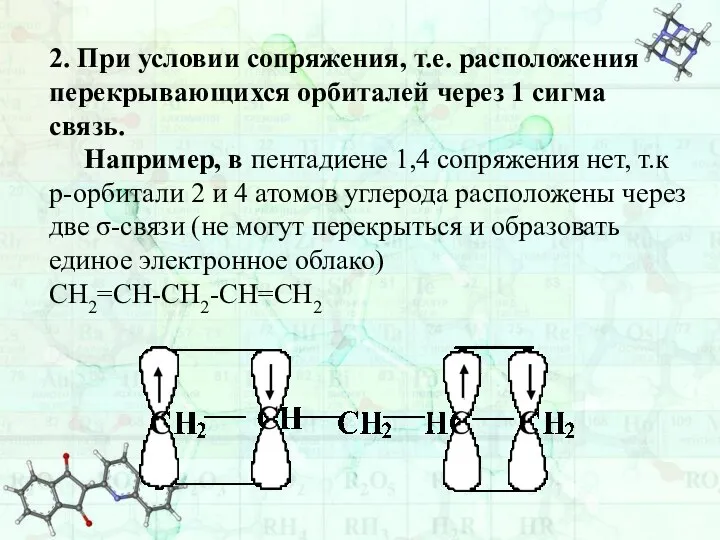
- 42. 2. При условии сопряжения, т.е. расположения перекрывающихся орбиталей через 1 сигма связь. Например, в пентадиене 1,4
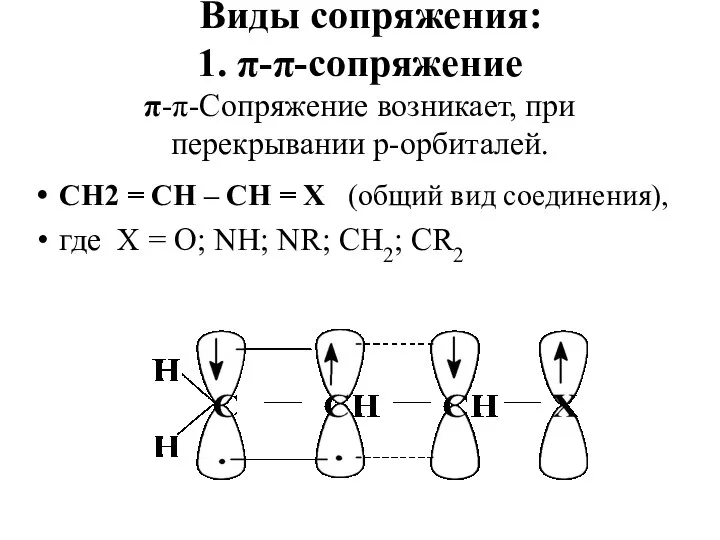
- 43. Виды сопряжения: 1. π-π-сопряжение π-π-Сопряжение возникает, при перекрывании р-орбиталей. СН2 = СН – СН = Х
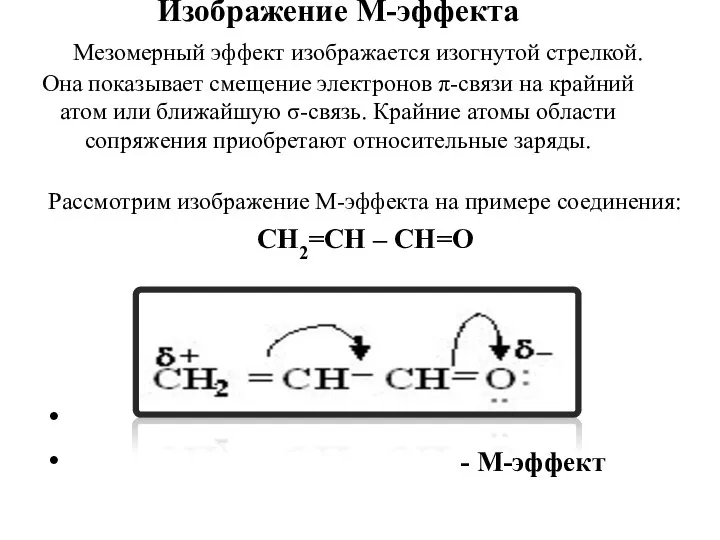
- 44. Изображение М-эффекта Мезомерный эффект изображается изогнутой стрелкой. Она показывает смещение электронов π-связи на крайний атом или
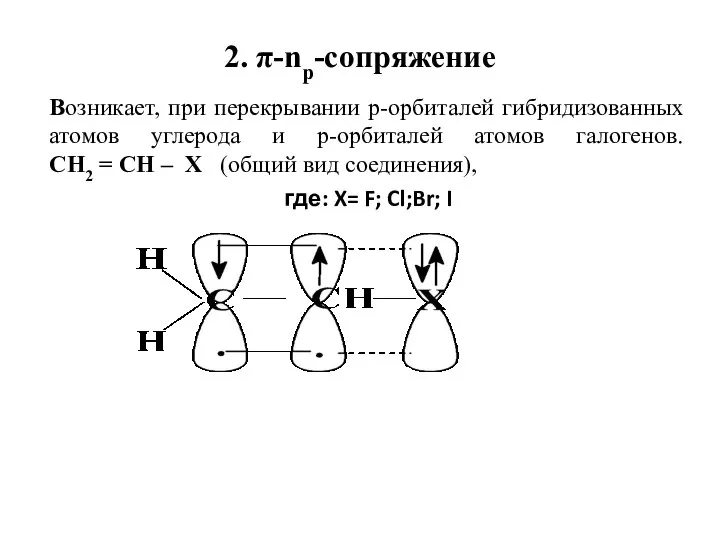
- 45. 2. π-np-сопряжение Возникает, при перекрывании р-орбиталей гибридизованных атомов углерода и р-орбиталей атомов галогенов. СН2 = СН
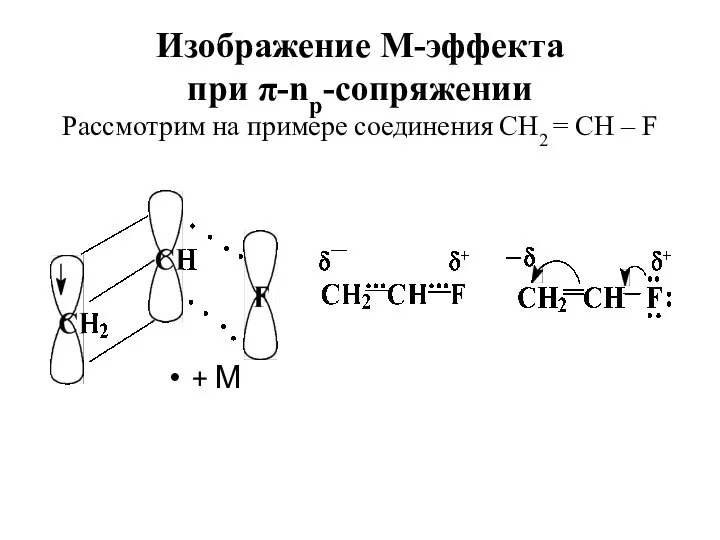
- 46. Изображение М-эффекта при π-np-сопряжении Рассмотрим на примере соединения СН2 = СН – F + М
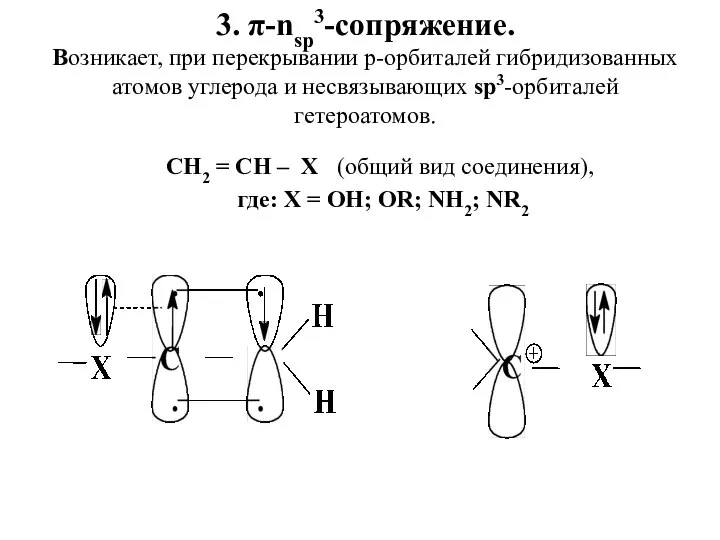
- 47. 3. π-nsp3-сопряжение. Возникает, при перекрывании р-орбиталей гибридизованных атомов углерода и несвязывающих sp3-орбиталей гетероатомов. СН2 = СН
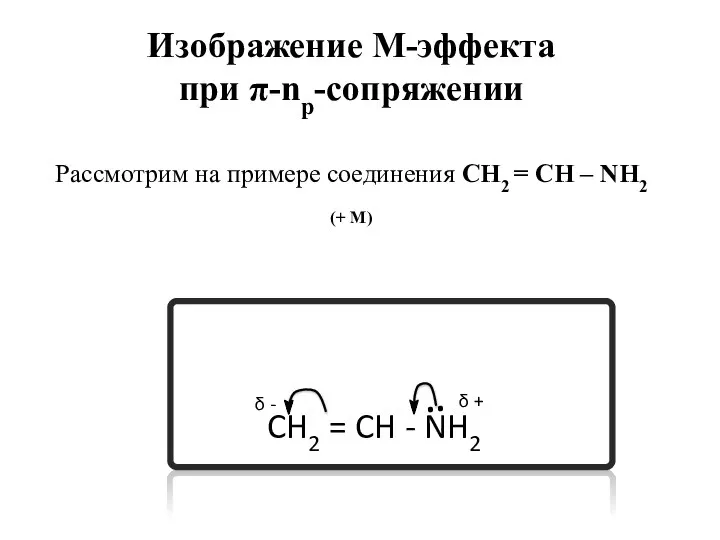
- 48. Изображение М-эффекта при π-np-сопряжении Рассмотрим на примере соединения СН2 = СН – NН2 (+ M) CH2
- 49. На слайдах 50-52 представлены все виды сопряжения, для сравнения, изучите -писать не нужно.
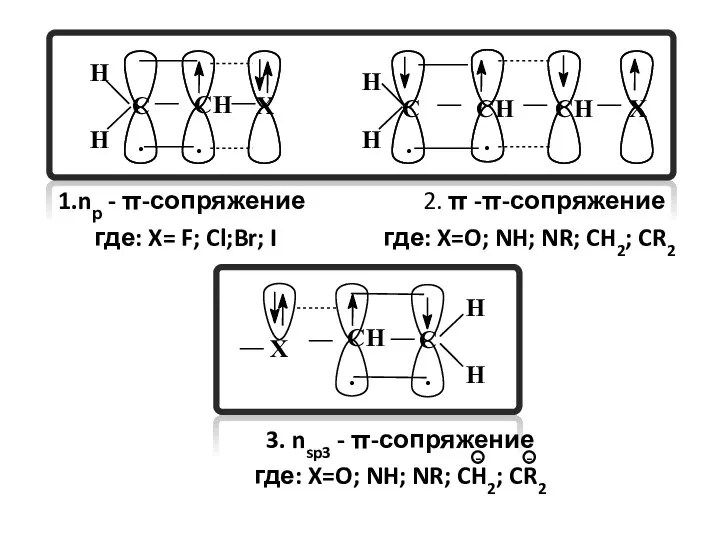
- 50. 1.nр - π-сопряжение 2. π -π-сопряжение где: X= F; Cl;Br; I где: X=O; NH; NR; CH2;
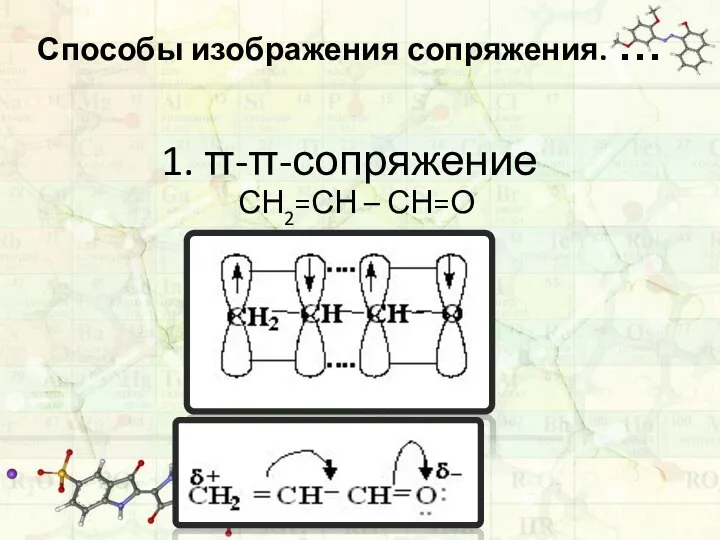
- 51. Способы изображения сопряжения. … 1. π-π-сопряжение СН2=СН – СН=О
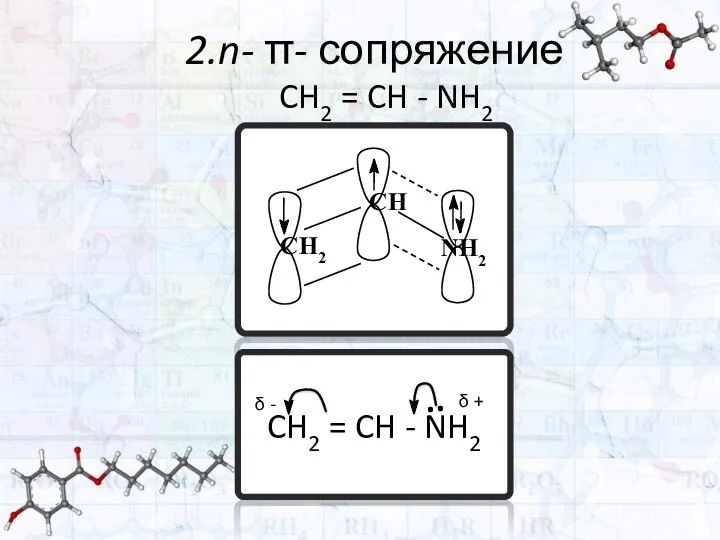
- 52. 2.n- π- сопряжение CH2 = CH - NH2 CH2 = CH - NH2 δ - δ
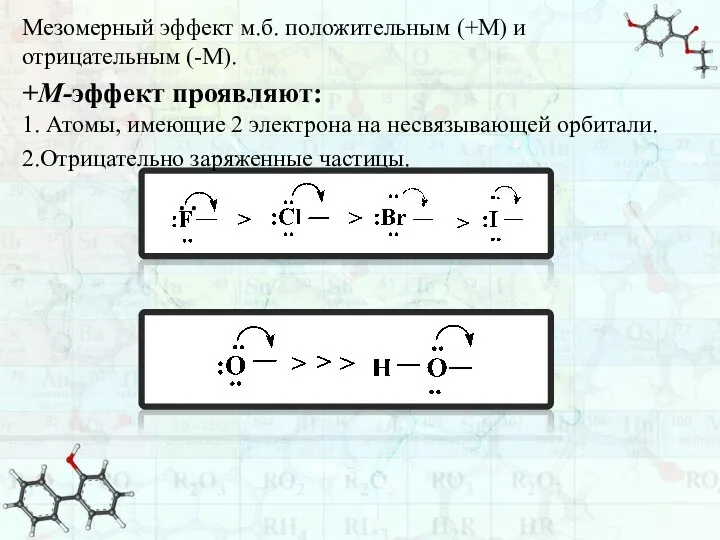
- 53. Мезомерный эффект м.б. положительным (+М) и отрицательным (-М). +М-эффект проявляют: 1. Атомы, имеющие 2 электрона на
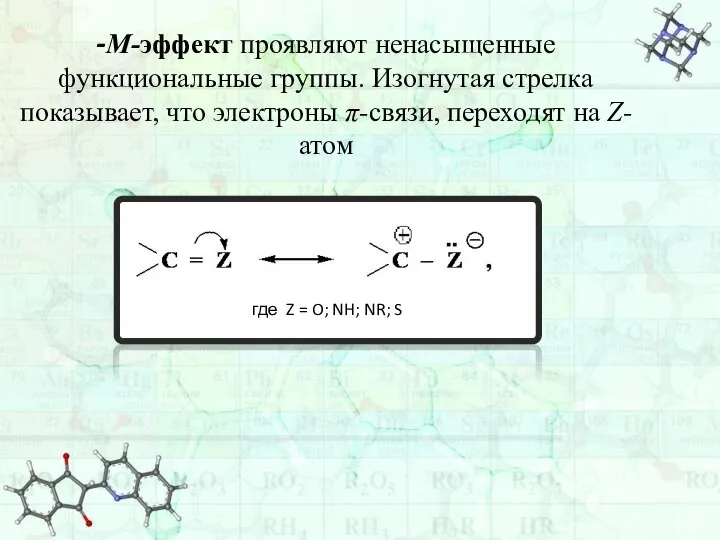
- 54. -М-эффект проявляют ненасыщенные функциональные группы. Изогнутая стрелка показывает, что электроны π-связи, переходят на Z-атом где Z
- 55. Положительный мезомерный эффект больше отрицательного индукционного эффекта, т.е. + М > –I, Исключение галогены, для которых:
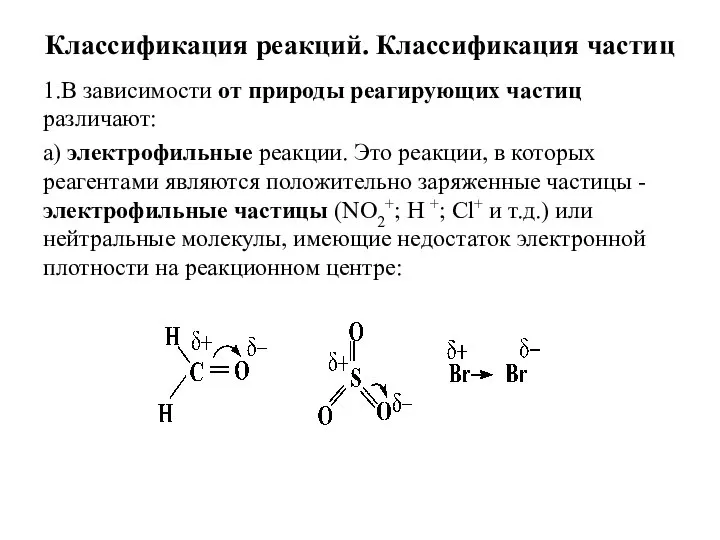
- 56. Классификация реакций. Классификация частиц 1.В зависимости от природы реагирующих частиц различают: а) электрофильные реакции. Это реакции,
- 57. б)Нуклеофильные реакции – это реакции, протекающие при действии нуклеофильных реагентов. Нуклеофильные реагенты – это отрицательно заряженные
- 59. Скачать презентацию

























 Фосфор. Тест по химии для 9 класса
Фосфор. Тест по химии для 9 класса Дигибридное скрещивание.Третий закон Г.Менделя.
Дигибридное скрещивание.Третий закон Г.Менделя. Углеводороды
Углеводороды Презентация на тему Фолиевая кислота
Презентация на тему Фолиевая кислота  Ароматические углеводороды
Ароматические углеводороды Алкены
Алкены Основания, их состав и название
Основания, их состав и название Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"
Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"  Классификация органических веществ Химия. 10 класс Абрамова С.И.
Классификация органических веществ Химия. 10 класс Абрамова С.И. Презентация на тему Фосфор 9 класс
Презентация на тему Фосфор 9 класс  Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды
Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды Пространственное строение. Стереоизомерия. Структура и функции биолекул
Пространственное строение. Стереоизомерия. Структура и функции биолекул Спирты
Спирты Получение волокон на основе сверхвысокомолекулярного полиэтилена
Получение волокон на основе сверхвысокомолекулярного полиэтилена Определение понятия сплавов. Сплавы на основе железа и меди
Определение понятия сплавов. Сплавы на основе железа и меди Полиморфизм. Аморфные вещества
Полиморфизм. Аморфные вещества Молекулярно-механическое изнашивание
Молекулярно-механическое изнашивание Основы квантовой химии
Основы квантовой химии Внеклассное мероприятие по химии Первоначальные химические понятия
Внеклассное мероприятие по химии Первоначальные химические понятия Химические свойства кислот. 11 класс
Химические свойства кислот. 11 класс Лучший тест для подготовки к ЕГЭ по химии
Лучший тест для подготовки к ЕГЭ по химии Презентация на тему Химические свойства и применение алканов
Презентация на тему Химические свойства и применение алканов  Парафины или алканы. Циклоалканы или нафтены
Парафины или алканы. Циклоалканы или нафтены Тест для подготовки к ГИА по химии
Тест для подготовки к ГИА по химии Щелочноземельные металлы
Щелочноземельные металлы Превращения веществ
Превращения веществ Задания для подготовки к ЕГЭ по химии
Задания для подготовки к ЕГЭ по химии ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски
ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски