Содержание
- 2. Цель? Переливание компонентов крови должно производиться по строгим показаниям, когда требуемый лечебный эффект может быть достигнут
- 3. Гемотрансфузия осуществляется врачом, прошедшим обучение, сдавшим зачет и имеющим допуск к проведению гемотрансфузии.
- 4. Перед назначением гемотрансфузии (или при поступлении больного в стационар) собирают трансфузионный, а у женщин, кроме того,
- 5. У всех больных, которым может потребоваться переливание компонентов крови, должны быть проведены иммуногематологические исследования крови.
- 6. Для повышения иммуногематологической безопасности при использовании компонентов крови целесообразно разделить реципиентов на две группы: - «опасные
- 7. «Опасные реципиенты» 1. Больные с биологической особенностью образца крови (наличие слабых вариантов антигенов, парциальных антигенов, врожденный
- 8. 2. Больные с наличием аллоиммунных антиэритроцитарных антител любой активности и специфичности. 3. Больные с отягощенным акушерским
- 9. 4. Беременные женщины. 5. Дети. 6. Больные с онкогематологическими заболеваниями. 7. Больные с тяжелыми поражениями почек
- 10. 8. Больные, у которых выявлена несовместимость в любой из проб. 9. Больные, которым планируется перелить компоненты
- 11. Опасным реципиентам гемотрансфузии проводят только после индивидуального подбора компонентов крови
- 12. Алгоритм иммуногематологического исследования крови реципиентов 1. Первичное определение группы крови реципиента проводит лечащий (дежурный) врач. 2.
- 13. Объем исследования, проводимого лечащим (дежурным) врачом: - определение группы крови системы АВО простой реакцией изогемагглютинирующими сыворотками,
- 14. Результат первичного исследования лечащий врач записывает на этикетку, прикрепленную к пробирке с кровью реципиента, а также
- 15. Этикетка, прикрепленная к пробирке с кровью реципиента, должна содержать следующие данные: наименование лечебного отделения Ф. И.О.,
- 16. Объем обязательных исследований при подтверждающем определении: определение группы крови системы АВО перекрестной реакцией; определение антигена D
- 17. Результаты подтверждающего исследования регистрируют в специальном журнале, пронумерованном, прошнурованном, заверенном подписью главного врача и печатью, имеющем
- 18. Заключение о результатах подтверждающего исследования крови реципиента направляют в лечебное отделение. При совпадении результатов первичного и
- 19. При несовпадении результатов исследования специалист, выявивший несовпадение, НЕЗАМЕДЛИТЕЛЬНО сообщает лечащему врачу (устно и письменно), и комиссионно,
- 20. Если при подтверждающем иммуногематологическом исследовании выявлены: - аллоиммунные антиэритроцитарные антитела любой специфичности и активности; - фиксированные
- 21. Образец крови реципиента после подтверждающего иммуногематологического исследования хранится в лаборатории в течение 3 суток и в
- 22. Если при подтверждающем иммуногематологическом исследовании выявлены аллоиммунные антиэритроцитарные антитела любой специфичности и активности; фиксированные на эритроцитах
- 23. Если показания для гемотрансфузии являются абсолютными, то переливание проводят только после индивидуального подбора.
- 24. Показания к назначению СЗП При продолжающемся кровотечении, операции при показателях МНО>1,5, АЧТВ >45 сек
- 25. Lacroix J; N Eng J Med 2007; 356:1609-1619 Исследование TRIPICU. Протокол Либеральная стратегия Переливание при Hb
- 26. Lacroix J; N Eng J Med 2007; 356:1609-1619 Исследование TRIPICU. Заключение „… может безопасно сократить частоту
- 27. NEJM 2007;356:1609-1619 Lacroix J. et al
- 28. Эритроциты Планета Обедненные лейкоцитами Россия Фильтрованные
- 29. Остаточные лейкоциты ??? Фильтрованные Нужен метод и контроль качества
- 30. Приказ МЗ РФ № 193 от 7.05.2003 «О внедрении в практику работы службы крови в Российской
- 31. Методические рекомендации по лабораторному предупреждению передачи ВИЧ при переливании крови и ее компонентов (утв. Минздравсоцразвития России
- 32. ДИРЕКТИВА 2002/98/ЕС от 27.01.2003 Обследование должно проводится с применением последних достижений науки, которые отражают лучшую практику,
- 35. Вариабельны в зависимости от: Глубина анестезии Миорелаксация Температура тела FiO2 Функция миокарда ОЦК Замещение объема „Критические“
- 36. Соотношение перелитых доз эритроцитов : СЗП Финляндия 6,0 Германия 3,2 США 3,6 Швеция 3,7 Дания 5,8
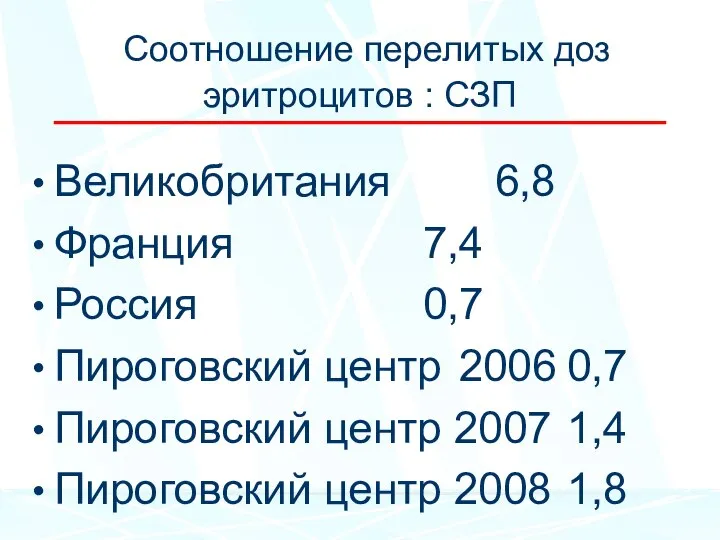
- 37. Соотношение перелитых доз эритроцитов : СЗП Великобритания 6,8 Франция 7,4 Россия 0,7 Пироговский центр 2006 0,7
- 38. Инструкция по применению компонентов крови (утв. приказом Минздрава России от 25 ноября 2002 г. № 363)
- 39. Seekamp A. Eur J Emerg Med 1995:2;28 Активность факторов свертывания: 37 оС 100% 37±3 оС 22
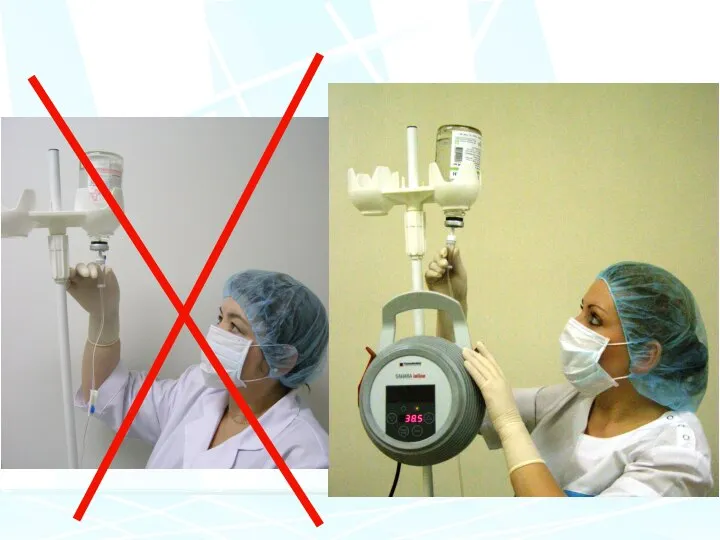
- 42. При трансфузиях новорожденным, эритроциты и плазму делили в четыре контейнера. Донорское воздействие сократилось на - 57%.
- 44. Скачать презентацию







































 Особенности анестезиологического обеспечения лапароскопических операций у гинекологических больных с выраженным ожирением
Особенности анестезиологического обеспечения лапароскопических операций у гинекологических больных с выраженным ожирением Пальчиковые игры с массажным мячиком Су-Джок
Пальчиковые игры с массажным мячиком Су-Джок Лекция № 2 Чувствительность и ее расстройства
Лекция № 2 Чувствительность и ее расстройства Невротическая форма заикания
Невротическая форма заикания Артроз суставов. Продукция EnjoyNT:
Артроз суставов. Продукция EnjoyNT: Остеоартрит (для пациентов)
Остеоартрит (для пациентов) Специфика послеоперационной работы
Специфика послеоперационной работы Актуальність : частота – хронічні синуїти складають 50- 55% госпіталізованої ЛОР-патології, 35- 50% амбулаторних ЛОР-хворих;частота – х
Актуальність : частота – хронічні синуїти складають 50- 55% госпіталізованої ЛОР-патології, 35- 50% амбулаторних ЛОР-хворих;частота – х Медицинская эвакуация, ее цели и назначение
Медицинская эвакуация, ее цели и назначение Physical medicine & rehabilitation & rheumatology or physiatry (rehabilitation medicine)
Physical medicine & rehabilitation & rheumatology or physiatry (rehabilitation medicine) SBL
SBL Зрительные функции. Оптическая система глаза
Зрительные функции. Оптическая система глаза Уход за пациентами. Роль медсестры в жизни пациентов
Уход за пациентами. Роль медсестры в жизни пациентов Обращение с медицинскими отходами
Обращение с медицинскими отходами Амилоидоз. AL-амилоидоз: клиническое наблюдение
Амилоидоз. AL-амилоидоз: клиническое наблюдение Цирроз печени
Цирроз печени Диета с повышенным содержанием макулярных ксантофиллов в профилактике глазных заболеванийс
Диета с повышенным содержанием макулярных ксантофиллов в профилактике глазных заболеванийс Молекулярные биомаркеры при ЧМТ, их диагностическое и прогностическое значение
Молекулярные биомаркеры при ЧМТ, их диагностическое и прогностическое значение Болезнь меньера – негнойное заболевание внутреннего уха
Болезнь меньера – негнойное заболевание внутреннего уха Діабетична полінейропатія
Діабетична полінейропатія Отделение анестезиологии-реанимации Северодвинского роддома
Отделение анестезиологии-реанимации Северодвинского роддома Жыныс мүшелерінің гистологиясы
Жыныс мүшелерінің гистологиясы Эмболизация маточных артерий как альтернатива гистерэктомии при лечении миомы матки
Эмболизация маточных артерий как альтернатива гистерэктомии при лечении миомы матки Хроническая сердечная недостаточность. Синдром сердечной недостаточности
Хроническая сердечная недостаточность. Синдром сердечной недостаточности Классификация афазии
Классификация афазии Паспорт буферного терминала АБЖК-3 ОБП Южно - Приобского м/р
Паспорт буферного терминала АБЖК-3 ОБП Южно - Приобского м/р Diagnostické a léčebné postupy u poranění břicha
Diagnostické a léčebné postupy u poranění břicha Дифференциальная диагностика при абстинентном синдроме
Дифференциальная диагностика при абстинентном синдроме