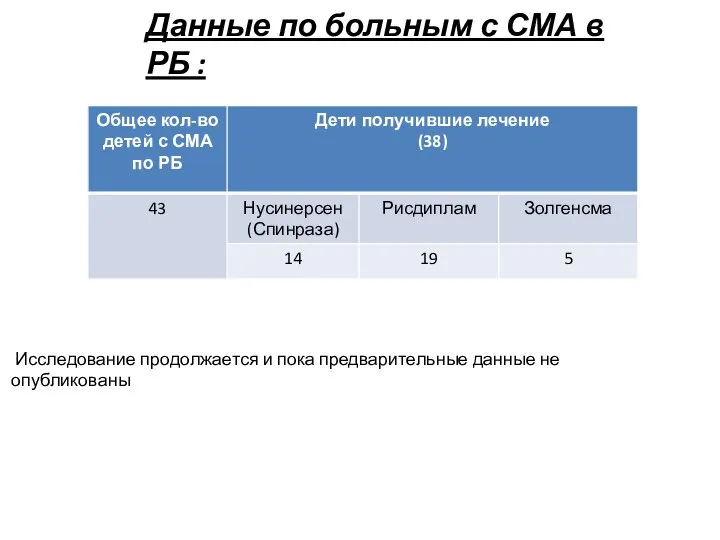
включен в перечень ЖВНЛП (жизненно необходимых и важнейший лекарственных препаратов) с 2021 года. Соответствующее распоряжение подписано Правительством РФ 23 ноября 2020 за номером 3073-р.
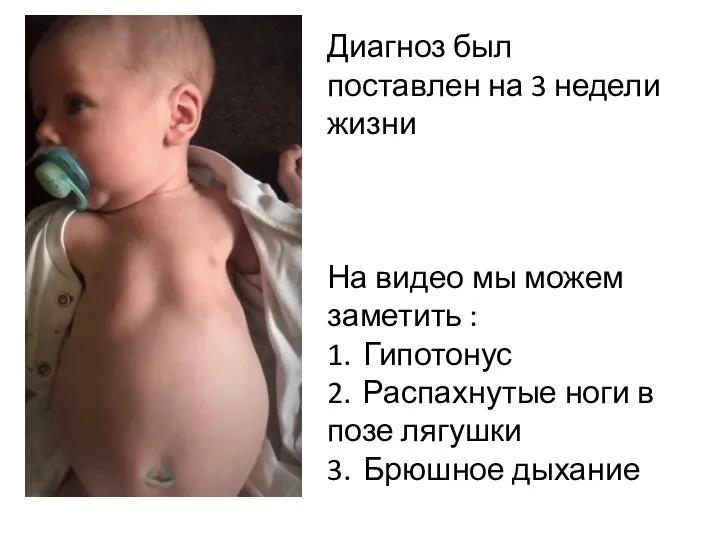
Спинраза — первый лекарственный препарат для патогенетического лечения СМА, зарегистрированный в России в августе 2019 года. Результаты клинических исследований и программы расширенного доступа к препарату демонстрируют остановку прогрессирования заболевания, часто восстановление утраченных моторных функций и улучшение качества жизни пациентов и лиц, осуществляющих за ними уход.
При отсутствии патогенетической терапии пациенты со спинальной мышечной атрофией неуклонно теряют моторные навыки, что приводит к тяжелой инвалидизации и летальному исходу. Помимо этого, включение препарата нусинерсен в перечень ЖВНЛП позволит, помимо всего, зафиксировать стоимость препарата и существенно сократить его стоимость. На данный момент средняя стоимость одной ампулы препарата достигает в среднем 8 млн. рублей.












 Влияние курения и алкоголя на развитие плода
Влияние курения и алкоголя на развитие плода Кератотопография роговицы (топография роговицы)
Кератотопография роговицы (топография роговицы) Принципы восстановления фертильности
Принципы восстановления фертильности Как отличить аллергию от коронавирусной инфекции?
Как отличить аллергию от коронавирусной инфекции? Выделение и его значение. Органы выделения
Выделение и его значение. Органы выделения ВИЧ. Классный час
ВИЧ. Классный час Первая медицинская помощь детям. Информация для родителей
Первая медицинская помощь детям. Информация для родителей Технологии развития артикуляционной моторики
Технологии развития артикуляционной моторики Мужские и женские молочные железы
Мужские и женские молочные железы Введение в курс гистологии. Определение гистологии как науки
Введение в курс гистологии. Определение гистологии как науки Лечение ГЭРБ. Показания к хирургическому лечению
Лечение ГЭРБ. Показания к хирургическому лечению Down syndrome
Down syndrome Пневмонии. Плевриты (лекция 1)
Пневмонии. Плевриты (лекция 1) Проведение анализа тела человека с применением современного оборудования
Проведение анализа тела человека с применением современного оборудования Клинический случай. Гиперплазия коры надпочечников
Клинический случай. Гиперплазия коры надпочечников Artificial synthesis of insulin
Artificial synthesis of insulin Влияние технологий подготовки к родам на уровень инфекций, связанных с оказанием медицинской помощи в послеродовом периоде
Влияние технологий подготовки к родам на уровень инфекций, связанных с оказанием медицинской помощи в послеродовом периоде Осмотр системы органов дыхания
Осмотр системы органов дыхания Моё мнение о наркотиках
Моё мнение о наркотиках Гипертрофическая кардиомиопатия
Гипертрофическая кардиомиопатия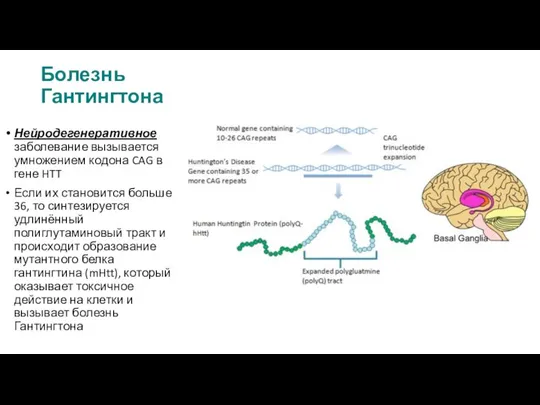 Болезнь Гантингтона
Болезнь Гантингтона Влияние выбора метода родоразрешения на материнский исход
Влияние выбора метода родоразрешения на материнский исход Жануарлардың тейлериидоздары
Жануарлардың тейлериидоздары Плоскостопие
Плоскостопие COVID-инфекция и глаз
COVID-инфекция и глаз Дифференциалды диагноз
Дифференциалды диагноз Анализ и гигиеническая оценка рынка
Анализ и гигиеническая оценка рынка Гемотрансфузия
Гемотрансфузия